Phản ứng NaClO + CO2 + H2O → Na2CO3 + HClO
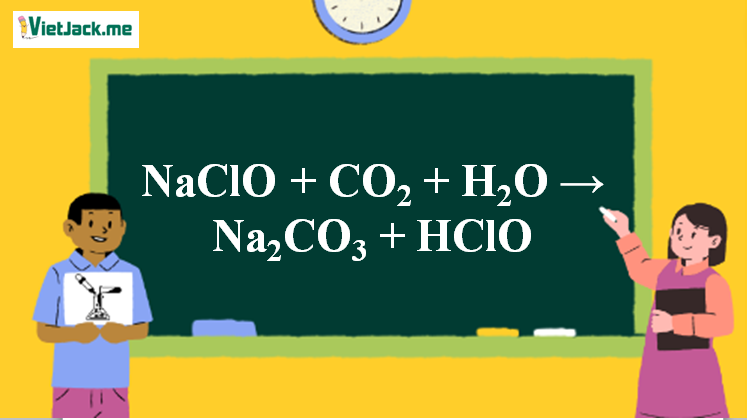
1. Phương trình phản ứng NaClO ra HClO
2NaClO + CO2 + H2O → Na2CO3 + 2HClO
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
3. Hiện tượng phản ứng xảy ra
NaClO có tính oxi hóa rất mạnh.
NaClO là muối của axit yếu (yếu hơn axit cacbonic), trong không khí nó tác dụng dần với CO2 tạo HClO không bền.
4. Tính chất hoá học của NaClO
– Đây là một hợp chất muối natri vì vậy nó có đầy đủ tính chất hóa học của Muối.
– NaClO sẽ phản ứng với các kim loại với tốc độ phản ứng chậm tạo ra các hợp chất của Oxy và hợp chất muối.
NaClO + Zn → ZnO + NaCl
– NaClO sẽ phản ứng với axit clohiđric để giải phóng khí clo, nước và muối natri clorua.
NaClO + 2HCl → Cl2 + H2O + NaCl
– NaClO sẽ phản ứng với các axit khác, như axit axetic, để tạo ra axit hypoclorơ.
NaClO + CH3COOH → HClO + CH3COONa
– NaClO dưới tác dụng của nhiệt độ nó sẽ bị phân hủy thành natri clorat và natri clorua:
3NaClO → NaClO3 + 2NaCl.
5. Điều chế NaClO
Trong công nghiệp, Natri hypoclorit được sản xuất bằng cách điện phân có màng ngăn với việc dẫn khí clo vào dung dịch natri hydroxit nguội loãng. Điều kiện điều chế đó là dung dịch phải giữ ở nhiệt độ dưới 40 °C để tránh sự hình thành natri clorat.
Cl2 + 2 NaOH → NaCl + NaClO + H2O
Trong phòng thí nghiệm chúng ta sẽ tìm thấy các phản ứng khác dùng để điều chế NACLO như sau:
Điện phân dung dịch Natri clorua và nước không màng ngăn bằng cách cho nước tác dụng với Nacl
H2O + NaCl ⟶ H2 +NaClO.
Na2CO3 + Ca(ClO)2 ⟶ CaCO3 + 2NaClO.
2NaOH + NO2Cl ⟶ H2O + NaClO + NaNO2.
NaOH + HClO ⟶ H2O + NaClO.
6. Mở rộng kiến thức về CO2
6.1. Tính chất vật lý
– Là chất khí không màu, nặng gấp 1,5 lần không khí.
– Tan ít trong nước.
– CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
6.2. Tính chất hóa học
Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
a. CO2 là oxit axit
– CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu):
CO2 (k) + H2O (l) ⇔ H2CO3 (dd)
– CO2 tác dụng với oxit bazơ → muối:
CaO + CO2 → CaCO3 (tº)
– CO2 tác dụng với dung dịch kiềm → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
b. CO2 bền, ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 ⇔ 2CO + O2 (tº)
CO2 + 2Mg → 2MgO + C (Đây là nguyên nhân không sử dụng CO2 để dập tắt các đám cháy kim loại)
CO2 + C → 2CO
c. CO2 còn được dùng để sản xuất ure
CO2 + 2NH3 → NH4O – CO – NH2 (amoni cacbamat)
NH4O – CO – NH2 → H2O + (NH2)2CO (180ºC; 200at)
6.3. Điều chế
– Quá trình hô hấp của người và động vật:
C6H12O6 + 6O2 → 6CO2 + 6H2O
– Quá trình lên men bia rượu:
C6H12O6 → 2CO2 + 2C2H5OH
– Quá trình đốt cháy nhiên liệu:
CxHy + (x + y/4)O2 → xCO2 + y/2 H2O
– Trong công nghiệp:
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (1000ºC)
– Trong phòng thí nghiệm:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
7. Câu hỏi vận dụng liên quan
Câu 1. Natri hipoclorit là chất nào sau đây?
A. NaCl.
B. NaClO3.
C. NaClO4.
D. NaClO
Lời giải
Đáp án: D
Câu 2. Nước Clo có tính tẩy màu vì
A. khi dẫn khí clo vào nước không xảy ra phản ứng hoá học
B. clo tác dụng với nước tạo nên axit HCl có tính tẩy màu
C. clo hấp phụ được màu
D. clo tác dụng nước tạo nên axit HClO có tính tẩy màu
Lời giải
Đáp án: D
Câu 3. Chọn câu đúng cho các câu sau:
A. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit.
B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
C. Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit.
D. Clorua vôi không phải là muối .
Lời giải
Đáp án: B
Câu 4. Trong công nghiệp, nước Gia-ven được điều chế bằng cách
A. điện phân dung dịch NaCl có màng ngăn.
B. điện phân dung dịch NaCl không có màng ngăn.
C. cho khí clo tác dụng với dung dịch NaOH.
D. cho khí flo tác dụng với dung dịch NaOH.
Lời giải
Đáp án: B
Trong công nghiệp, nước Gia-ven được điều chế bằng cách điện phân dung dịch NaCl không có màng ngăn.
Xem thêm các phương trình phản ứng hóa học khác:
NaOH + HCl → NaCl + H2O
NaOH + H2SO4 → Na2SO4 + H2O
NaCl → Na + Cl2
NaCl + H2O → NaOH + Cl2 + H2
NaCl + H2SO4 → NaHSO4 + HCl
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




