Phản ứng Fe(OH)3 → Fe2O3 + H2O
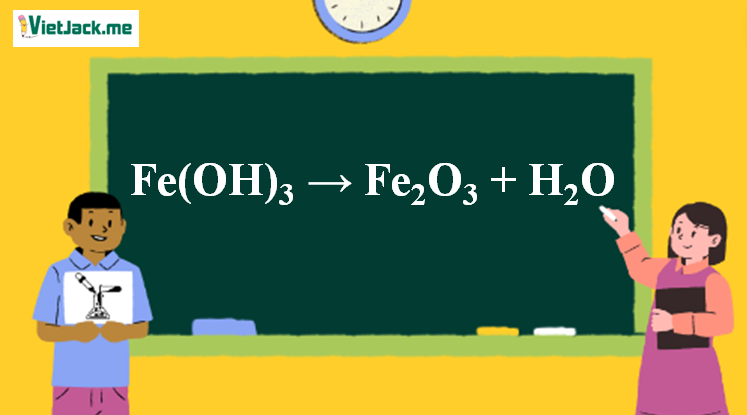
1. Phương trình nhiệt phân Fe(OH)3
2Fe(OH)3↓ Fe2O3 + 3H2O
2. Điều kiện để phản ứng Fe(OH)3 ra Fe2O3
Nhiệt độ
3. Bazơ không tan bị nhiệt phân huỷ tạo thành oxit và nước
Tương tự Fe(OH)3, một số bazơ không tan khác như Cu(OH)2, Al(OH)3,… cũng bị nhiệt phân huỷ tạo ra oxit và nước.
Cu(OH)2 CuO + H2O
4. Bản chất của Fe(OH)3 (Sắt (III) hidroxit) trong phản ứng
Fe(OH)3 mang đầy đủ tính chất hoá học của một bazo không tan nên bị nhiệt phân khi có nhiệt độ.
5. Tính chất hóa học của Fe(OH)3
Tính chất của Sắt hidroxit Fe(OH)3
Là một hidroxit tạo bởi Fe3+ và nhóm OH. Tồn tại ở trạng thái rắn, có màu nâu đỏ.
Công thức phân tử: Fe(OH)3
Tính chất vật lí: Là chất rắn, màu nâu đỏ, không tan trong nước.
5.1. Fe(OH)3 bị nhiệt phân
2Fe(OH)3↓ Fe2O3 + 3H2O
5.2. Tác dụng với axit
Fe(OH)3+ 3HCl → FeCl3 + 3H2O
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
5.3. Điều chế Fe(OH)3
Cho dung dịch bazơ vào dung dịch muối sắt (III).
Fe3+ + 3OH– → Fe(OH)3
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3 ↓ + 3BaCl2
5.4. Ứng dụng
Oxit sắt màu vàng, hay Pigment Yellow 42, được Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê chuẩn cho sử dụng trong mỹ phẩm và được sử dụng trong một số loại mực xăm.
6. Bài tập vận dụng liên quan
Câu 1. Bazo nào dưới đây bị nhiệt phân hủy tạo thành oxit và nước
A. Ba(OH)2.
B. Ca(OH)2.
C. KOH.
D. Zn(OH)2.
Lời giải:
Câu 2. Dãy bazo nào sau đây bị nhiệt phân hủy
A. Ba(OH)2, NaOH, Zn(OH)2, Fe(OH)3.
B. Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2.
C. Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2.
D. Zn(OH)2, Ca(OH)2, KOH, NaOH.
Lời giải:
Đáp án: C
Câu 3. Chỉ dùng nước có thể nhận biết chất rắn nào trong 4 chất rắn sau đây:
A. Zn(OH)2
B. Fe(OH)3
C. KOH
D. Al(OH)3
Lời giải:
Câu 4. Cặp chất tồn tại trong một dung dịch (chúng không phản ứng với nhau):
A. NaOH và KCl
B. NaOH và HCl
C. NaOH và MgCl2
D. NaOH và Al(OH)3
Lời giải:
Câu 5. Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: KCl, Ba(OH)2, KOH, K2SO4. Chỉ cần dùng thêm 1 hóa chất nào sau đây để nhận biết các dung dịch trên?
A. quỳ tím
B. dung dịch HCl
C. dung dịch BaCl2
D. dung dịch KOH
Lời giải:
Trích mẫu thử ra ống nghiệm khác nhau và đánh số thứ tự tương ứng.
Cho quỳ tím vào mẫu thử từng chất và quan sát, thấy:
Những dung dịch làm quỳ tím đổi màu là: KOH và Ba(OH)2, (nhóm 1).
Những dung dịch không làm quỳ tím đổi màu là: KCl, K2SO4 (nhóm 2).
Để nhận ra từng chất trong mỗi nhóm, ta lấy một chất ở nhóm (1), lần lượt cho vào mỗi chất ở nhóm (2), nếu có kết tủa xuất hiện thì chất lấy ở nhóm (1) là Ba(OH)2 và chất ở nhóm (2) là K2SO4. Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng hóa học:
Ba(OH)2 + K2SO4→ BaSO4 + KOH
Câu 6. Hòa tan hết m gam nhôm vào dung dịch NaOH 1M, thu được 13,44 lít khí (đktc). Thể tích dung dịch NaOH cần dùng là
A. 200 ml
B. 150 ml
C. 400 ml
D. 300 ml
Lời giải:
nH2(đktc) = VH222,4 = 13,4422,4= 0,6 (mol)
Phương trình phản ứng hóa học
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(mol) 0,4 ← 0,6
Theo phương trình phản ứng hóa học
nNaOH = 23nH2 =23.0,6 = 0,6 (mol)
→ VNaOH = nNaOH : CM= 0,41 = 0,4 (lít) = 400 (ml)
Câu 7. Để hoà tan hoàn toàn 13,6 gam hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3), cần dùng vừa đủ V lít dung dịch HCl 0,5M. Giá trị của V là :
A. 1,8.
B. 0,8.
C. 2,3.
D. 1,6.
Lời giải:
Vì số mol của FeO và Fe2O3 trong hỗn hợp bằng nhau nên ta quy đổi hỗn hợp FeO, Fe3O4 và Fe2O3 thành Fe3O4.
Ta có = 13,6233 = 0,05 mol.
nHCl = 2.nO (trong oxit) = 2 . 0,05 .4 = 0,4 (mol)
=> VHCl= 0,40,5 = 0,8 lít
Câu 8. Hoà tan hoàn toàn một lượng hỗn hợp X gồm Fe3O4 và FeS2 trong 31,5 gam HNO3, thu được 0,784 lít NO2 (đktc). Dung dịch thu được cho tác dụng vừa đủ với 100 ml dung dịch NaOH 2M, lọc kết tủa đem nung đến khối lượng không đổi thu được 4,88 gam chất rắn X. Nồng độ % của dung dịch HNO3 có giá trị là:
A. 47,2%.
B. 46,2%.
C. 46,6%.
D. 44,2%.
Lời giải:
Chất rắn X là Fe2O3
=> nFe2O3 = 4,88160 = 0,0305 mol
Áp dụng định luật bảo toàn nguyên tố Fe
=> nFe(OH)3= 2 nFe2O3 = 0.0305. 2 = 0,244 mol
Gọi số mol của Fe3O4, FeS2 lần lượt là x, y (mol)
Áp dụng định luật bảo toàn nguyên tố Fe
=> 3.nFe3O4 + nFeS2 = nFe(OH)3
=> 3x + y = 0,122 (1)
Áp dụng định luật bảo toàn electron
=> nFe3O4 + 15 . nFeS2 = nNO2
=> x + 15y = 0,035 (2)
Từ (1) và (2)
=> x = 0,02; y = 0,002
Áp dụng định luật bảo toàn nguyên tố Na
=> nNaOH = nNaNO3 + 2.nNa2SO4 (3)
nNa2SO4 = 2 . nFeS2= 0,001 . 2 = 0,002 mol (4)
=> nNaNO3 = 0,02 – 0,002 . 2 = 0,196 (mol)
Áp dụng định luật bảo toàn nguyên tố N là:
nHNO3 = nNaNO3 + nNO2 = 0,196 + 0,35 = 0,231 (mol)
=> C% HNO3 = 0,231.31,531,5 100% = 46,2%
Câu 9. Người ta tiến hành điều chế FeCl2 bằng cách cho Fe tác dụng với dung dịch HCl. Để bảo quản dung dịch FeCl2 thu được, không bị chuyển thành hợp chất sắt (III), người ta có thể cho thêm vào dung dịch chất gì để bảo quản
A. một lượng sắt dư .
B. một lượng kẽm dư.
C. một lượng HCl dư.
D. một lượng HNO3 dư.
Lời giải:
Câu 10. Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 1,5 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
A. 46,4 gam.
B. 23,2 gam.
C. 11,6 gam.
D. 34,8 gam.
Lời giải:
Theo bài ra, xác định được sau phản ứng chỉ thu được FeSO4
→ nFeSO4= nSO42- = naxit = 0,3 mol.
Bảo toàn nguyên tố Fe → nFe3O4 = 0,33 = 0,1 mol
→ m = 0,1.232 = 23,2 gam.
Câu 11. Hiện tượng xảy ra khi cho dung dịch Na2CO3 vào dung dịch FeCl3 là
A. Chỉ sủi bọt khí
B. Chỉ xuất hiện kết tủa nâu đỏ
C. Xuất hiện kết tủa nâu đỏ và sủi bọt khí
D. Xuất hiện kết tủa trắng hơi xanh và sủi bọt khí
Lời giải:
Phương trình phản ứng: 2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓(đỏ nâu) + 3CO2↑ + 6NaCl
Câu 12. Sản phẩm của phản ứng nhiệt phân nào dưới đây là không đúng?
A. NH4Cl → NH3+ HCl
B. NH4HCO3 → NH3+ H2O + CO2
C. NH4NO3 → NH3 + HNO3
D. NH4NO2 → N2 + 2H2O
Lời giải:
Câu 13. Trong phòng thí nghiệm, tiến hành điều chế H2 bằng cách cho Zn vào dung dịch HCl loãng. Khí H2 sẽ thoát ra nhanh hơn nếu thêm vào hệ phản ứng vài giọt dung dịch nào sau đây?
A. CuCl2
B. NaCl
C. MgCl2
D. AlCl3
Lời giải:
Để phản ứng xảy ra nhanh hơn người ta thêm CuCl2 vào vì CuCl2 + Zn → Cu + ZnCl2
→ tạo ra 2 kim loại là Zn và Cu → tạo ra hiện tượng điện hóa học khi 2 kim loại này cũng tác dụng với dung dịch H+ →Zn phản ứng với H+ nhanh hơn
Đáp án cần chọn là: A
Câu 14. Có 4 dung dịch riêng biệt: HCl; CuCl2; FeCl3; HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh Fe nguyên chất. Số trường hợp xuất hiện ăn mòn điện hoá là
A. 0
B. 1
C. 2
D. 3
Lời giải:
Fe + HCl: ăn mòn hóa học vì không hình thành 2 điện cực mới
Fe + CuCl2: ăn mòn điện hóa vì hình thành 2 điện cực Fe và Cu. Hai điện cực tiếp xúc với nhau và tiếp xúc với dung dịch điện li
Fe + FeCl3: ăn mòn hóa học vì không hình thành 2 điện cực mới
Fe + HCl có lẫn CuCl2: cả ăn mòn điện hóa và ăn mòn hóa học vì xảy ra các phản ứng sau
Fe + 2HCl → FeCl2 + H2 (ăn mòn hóa học vì không hình thành 2 điện cực mới)
Fe + CuCl2 → FeCl2 + Cu
→ Cu sinh ra bám vào thanh sắt và hình thành 2 điện cực cùng tiếp xúc với dung dịch chất điện li
→ xảy ra ăn mòn điện hóa
Câu 15. Để điều chế Fe(OH)2 trong phòng thí nghiệm, người ta tiến hành như sau: Đun sôi dung dịch NaOH sau đó cho nhanh dung dịch FeCl2 vào dung dịch NaOH này. Mục đích chính của việc đun sôi dung dịch NaOH là?
A. Phân hủy hết muối cacbonat, tránh việc tạo kết tủa FeCO3.
B. Đẩy hết oxi hòa tan, tránh việc oxi hòa tan oxi hóa Fe (II) lên Fe (III).
C. Để nước khử Fe (III) thành Fe (II).
D. Đẩy nhanh tốc độ phản ứng.
Lời giải:
Mục đích chính của việc đun sôi dung dịch NaOH là đẩy hết oxi hòa tan, tránh việc oxi hòa tan oxi hóa Fe (II) lên Fe (III).
Câu 16. Cho các phản ứng chuyển hóa sau:
NaOH + dung dịch X → Fe(OH)2;
Fe(OH)2+ dung dịch Y → Fe2(SO4)3;
Fe2(SO4)3 + dung dịch Z → BaSO4.
Các dung dịch X, Y, Z lần lượt là
A. FeCl3, H2SO4 đặc nóng, Ba(NO3)2.
B. FeCl3, H2SO4 đặc nóng, BaCl2.
C. FeCl2, H2SO4 đặc nóng, BaCl2.
D. FeCl2, H2SO4 loãng, Ba(NO3)2.
Lời giải:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
dd X
2Fe(OH)2 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 6H2O
dd Y
Fe2(SO4)3 + 3BaCl2→ 3BaSO4+ 2FeCl3
dd Z
Xem thêm các phương trình hóa học khác:
Fe2O3 + HCl → FeCl3 + H2O
FeCl3 + KOH → Fe(OH)3 + KCl
FeS + HCl → FeCl2 + H2S
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
FeCO3 + H2SO4 → Fe2(SO4)3 + SO2 + CO2 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.





