Phản ứng Ag2S + O2 → Ag + SO2
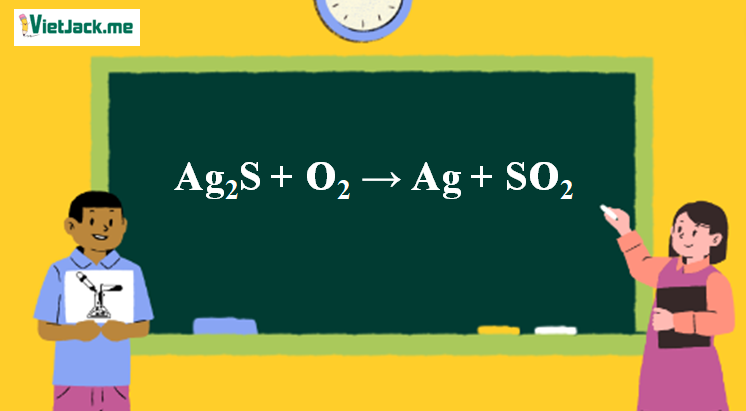
1. Phương trình phản ứng đốt Ag2S trong O2 dư
Ag2S + O2 Ag + SO2
2. Điều kiện phản ứng xảy ra
Nhiệt độ
3. Phương pháp điều chế Ag từ Ag2S
Ag2S là muối không tan, do vậy dùng HNO3 đặc để chuyển về muối tan AgNO3
Ag2S + 10HNO3→ 2AgNO3 + H2SO4+ 8NO2 + 4H2O
Tiếp tục dùng Zn để khử Ag+ về Ag
2AgNO3 + Zn → Zn(NO3)2 + 2Ag↓
4. Phương pháp nhiệt luyện
Dùng chất khử thích hợp như CO, C, Al, H2 khử ion kim loại trong oxit của chúng ở nhiệt độ cao.
5. Tính chất hóa học của O2
– Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
– Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
– Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, …) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
5.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
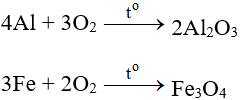
5.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
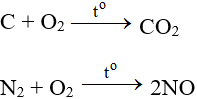
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
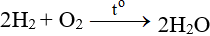
5.3. Tác dụng với hợp chất
– Tác dụng với các chất có tính khử:
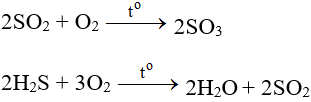
– Tác dụng với các chất hữu cơ:
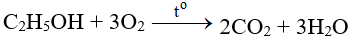
6. Tính chất của Ag2S
6.1. Tính chất hóa học
– Phản ứng khử
Ag2S có thể được khử thành bạc kim loại bằng cách tắm các mảnh màu đen bằng nước nóng, NaOH, nhôm và muối. Phản ứng sau đây diễn ra:
Ag2S (s) + 2Al (s) + 3H2O (l) → 6Ag (s) + 3H2S (ac) + Al2O3(s)
+ Nhiệt phân Ag2S ở nhiệt độ cao
Ag2S → 2Ag + S
+ Nghiền nhỏ quặng bạc sunfua Ag2S, xử lí bằng dung dịch natri xianua, rồi lọc để thu được dung dịch muối phức bạc. Phản ứng tương tự cũng sảy ra với KCN.
Ag2S + 4NaCN → Na2S + 2Na[Ag(CN)2]
Trường hợp có H2O tham gia phản ứng
H2O + Ag2S + 4NaCN → NaOH + NaSH + 2Na[Ag(CN)2]
– Đốt bạc sunfua sản phẩm tạo thành là bạc và khí SO2
O2 + Ag2S → 2Ag + SO2
6.2. Điều chế
Cho khí H2S tác dụng với bạc nitrat
2AgNO3 + H2S⟶2HNO3 + Ag2S
Hiện tượng: Xuất hiện kết tủa đen Ag2S.
6.3. Ứng dụng
Các ion bạc có đặc tính kháng khuẩn, nhưng không có nhiều công dụng của hợp chất bạc sunfua. Bạc sunfua được sử dụng trong nghiên cứu và trong các cảm biến màng trong dược phẩm, nhưng không có nhiều công dụng khác của hợp chất này. Sự thật thú vị Nó là một thành phần của phân tích vô cơ chất lượng cổ điển. Khi hình thành trên các tiếp điểm điện hoạt động trong bầu khí quyển giàu hydro sunfua, các sợi dài có thể được gọi là râu bạc có thể hình thành. Khi phá các rương kho báu gỗ trên những con thuyền lớn bị chìm có thể cung cấp sunfua cần thiết để tạo ra khí hydro sunfua. Khi kết hợp với bạc, khí hydro sunfua tạo ra một lớp bạc sunfua patina màu đen trên bạc, để bảo vệ lớp bạc bên trong.
6. Bài tập vận dụng liên quan
Câu 1. Cho các thí nghiệm sau:
(a) Đốt cháy Ag2S trong không khí.
(b) Điện phân dung dịch CuSO4 bằng điện cực trơ.
(c) Cho mẩu Na vào dung dịch CuSO4.
(d) Cho dung dịch NaI vào dung dịch FeCl3.
(e) Nhiệt phân FeCO3.
(g) Điện phân Al2O3 nóng chảy.
Số thí nghiệm tạo ra đơn chất là:
A. 6.
B. 3.
C. 5.
D. 4.
Lời giải:
Câu 2. Dãy gồm các kim loại đều có thể điều chế được bằng phương pháp nhiệt luyện là
A. Fe, Cu, Ag.
B. Fe, Cu, Ba.
C. Na, Fe, Cu.
D. Ca, Al, Fe.
Lời giải:
Câu 3. Những kim loại nào sau đây có thể được điều chế từ oxít bằng phương pháp nhiệt luyện nhờ chất khử CO?
A. Al, Mg, Fe
B. Ni, Cu, Ca
C. Fe, Ni, Zn
D. Fe, Al, Cu
Lời giải:
Xem thêm các phương trình hóa học khác:
AgCl → Cl2 + Ag
KMnO4 → K2MnO4 + MnO2 + O2
Mg + HCl → MgCl2 + H2
Mg + H2SO4 → MgSO4 + H2
Mg + HNO3 → Mg(NO3)2 + NO2 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




