Phản ứng Al2O3 + HCl → AlCl3 + H2O

1. Phương trình phản ứng Al2O3 ra AlCl3
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Nhôm oxit là oxit lưỡng tính, vừa tác dụng với axit vừa tác dụng với bazo.
Phương trình Al2O3 tác dụng với dung dịch kiềm:
Al2O3 + NaOH → NaAlO2 + H2O
2. Điều kiện Al2O3 tác dụng với HCl
Nhiệt độ thường
3. Mở rộng kiến thức liên quan Al2O3
3.1. Tính chất vật lí và nhận biết
Tính chất vật lí: Là chất rắn màu trắng, không tan trong nước, rất bền, nóng chảy ở 2050oC.
Nhận biết: Mang hòa tan Al2O3 vào dung dịch NaOH, thấy tan ra, tạo dung dịch không màu.
Al2O3 + 2NaOH → NaAlO2 + H2O
3.2. Tính chất hóa học
Al2O3 là oxit lưỡng tính
- Tác dụng với axit:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
- Tác dụng với dung dịch bazơ mạnh
Al2O3 + 2NaOH → NaAlO2 + H2O
hay
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH– → 2AlO2– + H2O
Al2O3 tác dụng với C
Al2O3 + 9C Al4C3 + 6CO
3.3. Điều chế Al2O3
Nhiệt phân Al(OH)3: 2Al(OH)3 Al2O3 + 3H2O
3.4. Ứng dụng Al2O3
– Ngành công nghiệp xây dựng: Nhôm oxit thường được sử dụng để sản xuất xi măng, một trong những nguyên liệu chính trong xây dựng. Nó cung cấp tính năng chống cháy và tạo độ cứng cho vật liệu xây dựng, đồng thời giúp tăng khả năng bám dính của xi măng.
– Ngành công nghiệp điện tử: Nhôm oxit cũng là thành phần chính trong việc sản xuất các loại sơn dẫn điện và sơn chịu nhiệt. Các sản phẩm này thường được ứng dụng trong việc gia công và sản xuất các linh kiện điện tử, đảm bảo tính ổn định và an toàn của các mạch điện tử.
– Ngành công nghiệp thực phẩm và dược phẩm: Nhôm oxit thường được sử dụng như một chất chống đông trong việc sản xuất thực phẩm và dược phẩm. Điều này đảm bảo sự an toàn và vệ sinh của các sản phẩm này trước khi đến tay người tiêu dùng.
– Ngành công nghiệp gốm sứ và thủy tinh: Nhôm oxit là một trong những thành phần quan trọng trong việc sản xuất gốm sứ và thủy tinh. Nó cung cấp tính chất chống nứt và tăng độ cứng cho các sản phẩm, đồng thời cũng làm cho chất liệu trở nên bóng đẹp và dễ sơn màu.
– Ngành công nghiệp dầu khí: Nhôm oxit được sử dụng để sản xuất chất trơ đặc biệt dùng trong công nghiệp dầu khí. Chất này giúp tạo ra các sản phẩm chống ăn mòn và bảo vệ thiết bị trong môi trường dầu khí khắc nghiệt.
– Ngành công nghiệp mỹ phẩm và mỹ phẩm: Trong ngành mỹ phẩm, nhôm oxit thường được sử dụng làm thành phần chống nắng, giúp bảo vệ da khỏi tác động của tia UV.
4. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
4.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl–
4.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 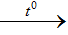 FeCl2 + H2
FeCl2 + H2
2Al + 6HCl 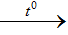 2AlCl3 + 3H2
2AlCl3 + 3H2
Cu + HCl → không có phản ứng
4.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 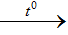 CuCl2 + H2 O
CuCl2 + H2 O
Fe2 O3 + 6HCl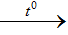 2FeCl3 + 3H2 O
2FeCl3 + 3H2 O
4.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 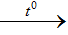 MnCl2 + Cl + 2H2 O
MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
5. Bài tập vận dụng liên quan
Câu 1. Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm
A. Al tác dụng với Fe3O4 nung nóng
B. Al tác dụng với H2SO4 đặc nóng
C. Al tác dụng với CuO đun nóng
D. Al tác dụng với Fe2O3 nung nóng
Lời giải:
Câu 2. Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch nước vôi trong
Lời giải:
Câu 3. Cho sơ đồ phản ứng: Al → X → Al2O3→ Al. X có thể là
A. AlCl3.
B. NaAlO2.
C. Al(NO3)3.
D. Al2(SO4)3.
Lời giải:
Câu 4. Phát biểu nào sau đây là sai?
A. Dung dịch AlCl3 và Al2(SO3)3 làm quỳ tím hóa hồng
B. Al(OH)3, Al2O3, Al đều là các chất lưỡng tính
C. Nhôm là kim loai nhẹ và có khả năng dẫn điện Iot
D. Từ Al2O3 có thế điều chế được Al.
Lời giải:
Câu 5. Cho 3,82 gam hợp kim Ba, Al vào nước dư chỉ thu được dung dịch chưa duy nhất một muối. Khối lượng Ba là:
A. 3.425 gam.
B. 1,644 gam.
C. 1,370 gam,
D. 2,740 gam
Lời giải:
Câu 6. Cho các chất: Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, K2SO3, (NH4)2CO3, Al. Số chất đều phản ứng được với dung dịch HCl, dung dịch NaOH là
A. 5
B. 6
C. 4
D. 7
Lời giải:
Al2O3, Zn(OH)2, NaHS, (NH4)2CO3, Al
Câu 7. Cho sơ đồ phản ứng sau: Al → X → Al2O3 → Y → Z → Al(OH)3. X, Y, Z lần lượt có thể là
A. AlCl3, Al2(SO4)3, NaAlO2
B. AlCl3, NaAlO2, Al2(SO4)3
C. Al(NO3)3, Al(OH)3, AlCl3
D. Al(NO3)3, NaAlO2, AlCl3
Lời giải:
Xem thêm các phương trình hóa học khác:
Al2O3 + H2SO4 → Al2(SO4)3 +H2O
Al(OH)3 + NaOH → NaAlO2 + H2O
Al(OH)3 + HCl → AlCl3 + H2O
Al2(SO4)3 + NaOH→ Al(OH)3 + Na2SO4
AlCl3 + NaOH → NaAlO2 + NaCl + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




