Phản ứng Al(OH)3 + HCl → AlCl3 + H2O
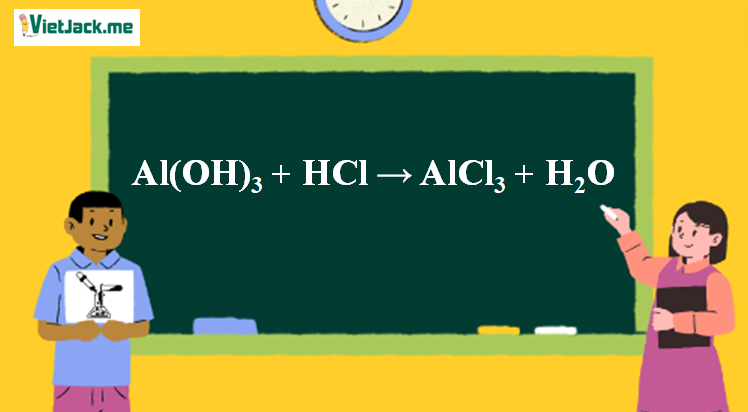
1. Phương trình phản ứng Al(OH)3 ra AlCl3
Al(OH)3 + 3HCl → AlCl3 + 3H2O
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
3. Hiện tượng phản ứng Al(OH)3 tác dụng với HCl
Chất rắn màu trắng của nhôm hiroxit (Al(OH)3) tan dần trong dung dịch.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Al(OH)3 (Nhôm hidroxit)
Al(OH)3 là một hidroxit lưỡng tính nên có thể tác dụng được với axit mạnh và dung dịch có tính kiềm mạnh.
4.2. Bản chất của HCl (Axit clohidric)
HCl là một axit mạnh tác dụng được với Al(OH)3.
5. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
5.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl–
5.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl  FeCl2 + H2
FeCl2 + H2
2Al + 6HCl  2AlCl3 + 3H2
2AlCl3 + 3H2
Cu + HCl → không có phản ứng
5.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl  CuCl2 + H2 O
CuCl2 + H2 O
Fe2 O3 + 6HCl 2FeCl3 + 3H2 O
2FeCl3 + 3H2 O
5.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2  MnCl2 + Cl + 2H2 O
MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
6. Tính chất hóa học của Al(OH)3
Kém bền với nhiệt: Khi đun nóng Al(OH)3 phân hủy thành Al2O3.
2Al(OH)3 Al2O3 + 3H2O
Là hiđroxit lưỡng tính:
Tác dụng với axit mạnh:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Tác dụng với dung dịch kiềm mạnh:
Al(OH)3 + KOH → KAlO2+ 2H2O
Al(OH)3 + KOH → K[Al(OH)4]
7. Tính chất vật lí của Al(OH)3
– Nhôm hidroxit thường tồn tại dưới dạng các tinh thể kết tinh không màu hoặc có màu trắng. Nó có dạng bột mịn khi được nghiền nhỏ.
– Tính chất tinh thể: Nhôm hidroxit có cấu trúc tinh thể dạng hệ một trục (trigonal) với các phân tử Al(OH)3 sắp xếp hình cầu đối xứng xung quanh nguyên tử nhôm.
– Điểm nóng chảy và sôi: Nhôm hidroxit không có điểm nóng chảy rõ rệt, thay vào đó, nó phân hủy thành nhôm oxit (Al2O3) và nước khi được đun nóng. Điều này thường xảy ra ở nhiệt độ cao hơn 200 độ Celsius.
– Tính tan và hòa tan: Nhôm hidroxit không tan trong nước, nhưng nó có thể tan trong axit mạnh và kiềm mạnh, tạo thành các muối hòa tan.
– Tính chất hóa học: Nhôm hidroxit có tính chất amphoteric, nghĩa là nó có thể tác dụng như một axit hoặc một bazơ trong các phản ứng hóa học. Nó có khả năng tương tác với cả axit mạnh và kiềm mạnh.
– Tính chất hút ẩm: Nhôm hidroxit có khả năng hút ẩm từ môi trường xung quanh, làm cho nó trở thành một chất hấp thụ nước hiệu quả.
– Khối lượng phân tử: Khối lượng phân tử của nhôm hidroxit là khoảng 78,0035 g/mol.
– Độ dẻo và cứng: Nhôm hidroxit là một chất rắn dễ nghiền, và nó có tính chất dẻo khi được ép hoặc nén.
Những tính chất vật lý này ảnh hưởng đến cách nhôm hidroxit được sử dụng trong các ứng dụng khác nhau, bao gồm sản xuất nhôm, công nghiệp hóa chất, dệt may, và nhiều ngành công nghiệp khác.
8. Ứng dụng của Al(OH)3
– Dược phẩm:
Thuốc kháng axit dạ dày: Nhôm hidroxit được sử dụng trong các loại thuốc dùng để giảm triệu chứng đầy bụng, trào ngược dạ dày, và đau dạ dày. Nó hoạt động bằng cách làm giảm acid dạ dày.
– Chất xử lý nước:
Nhôm hidroxit được sử dụng để điều chỉnh độ pH trong nước, đặc biệt trong quá trình xử lý nước cung cấp cho các hộ gia đình và các nhà máy xử lý nước.
– Công nghiệp dệt may và giấy:
Nhôm hidroxit được sử dụng làm chất tẩy trắng trong công nghiệp dệt may và giấy để làm cho sợi vải và giấy trắng hơn.
– Công nghiệp hóa chất:
Chất chống cháy: Nhôm hidroxit được sử dụng làm chất chống cháy trong sản xuất vật liệu cần độ bền chống cháy cao, như các vật liệu xây dựng hoặc vật liệu điện tử.
– Sản xuất nhôm:
Nhôm hidroxit là nguyên liệu chính để sản xuất nhôm. Quá trình nhiệt phân nhôm hidroxit tạo ra nhôm oxit, một bước quan trọng trong quá trình sản xuất nhôm.
– Mỹ phẩm và chăm sóc cá nhân:
Do khả năng tạo gel của nó trong nước, nhôm hidroxit thường được sử dụng trong các sản phẩm mỹ phẩm như kem dưỡng da và mỹ phẩm trang điểm.
– Chất phụ gia thực phẩm:
Nhôm hidroxit cũng được sử dụng như một chất phụ gia thực phẩm để điều chỉnh độ pH hoặc làm chất chống đông.
– Công nghiệp sản xuất giấy và sợi tổng hợp:
Nhôm hidroxit có thể được sử dụng để điều chỉnh độ pH trong quá trình sản xuất giấy và sợi tổng hợp.
– Sản xuất thuốc nhuộm và chất tẩy trắng:
Nhôm hidroxit có thể được sử dụng như một chất nền trong các loại thuốc nhuộm và chất tẩy trắng.
– Chất xử lý nước thải:
Nó được sử dụng trong các ứng dụng xử lý nước thải để kết tủa các chất hữu cơ và các kim loại nặng.
Nhôm hidroxit đóng vai trò quan trọng trong nhiều lĩnh vực công nghiệp và tiếp tục được sử dụng rộng rãi trong các ứng dụng khác nhau.
9. Bài tập vận dụng liên quan
Câu 1. Trong các dãy chất sau đây, dãy nào là những chất lưỡng tính
A. Cr(OH)3, Fe(OH)3, Mg(OH)2
B. Cr(OH)3, Zn(OH)2, Al(OH)3
C. Cr(OH)3, Zn(OH)2, Mg(OH)2
D. Cr(OH)3, Al(OH)3, Mg(OH)2
Lời giải:
Trong các dãy chất sau đây, dãy nào là những chất lưỡng tính là Cr(OH)3, Zn(OH)2, Al(OH)3
Loại A vì Fe(OH)3, Mg(OH)2 không phải là hợp chất lưỡng tính
Loại C vì Zn(OH)2 không phải là hợp chất lưỡng tính
Loại D vì Mg(OH)2 không phải là hợp chất lưỡng tính
Câu 2. Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(b) Cho Al(OH)3 vào dung dịch HCl.
(c) Cho Al vào dung dịch NaOH.
(d) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(e) Cho dung dịch NaOH vào dung dịch NaHCO3.
(g) Cho kim loại Al(OH)3 vào dung dịch FeCl3.
Số thí nghiệm có xảy ra phản ứng là
A. 5
B. 4
C. 6
D. 3
Lời giải:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
12HCl + 9Fe(NO3)2 → 5 Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
(c) Cho Al vào dung dịch NaOH.
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
(d) Cho dung dịch AgNO3 vào dung dịch FeCl3.
FeCl3 + 3AgNO3 → Fe(NO3)3 + 3AgCl ↓
(e) Cho dung dịch NaOH vào dung dịch NaHCO3.
NaHCO3 + NaOH → Na2CO3 + H2O
(g) Cho kim loại Cu vào dung dịch FeCl3.
Cu + 2FeCl3 → CuCl2+ FeCl2
Câu 3. Ở nhiệt độ chất rắn X không tan trong nước nhưng tan trong dung dịch kiềm NaOH, chất rắn đó là:
A. K
B. Na
C. Ca
D. Al
Lời giải:
Câu 4. Dùng thuốc thử nào sau đây để phân biệt được 3 chất rắn: Mg, Al, Al2O3 đựng trong các lọ riêng biệt:
A. NaOH
B. HCl đặc
C. H2SO4 đặc
D. NH3
Lời giải:
Sử dụng dung dịch NaOH
Al tan có xuất hiện khí
2Al + 2H2O + 2NaOH → 3H2 + 2NaAlO2
Al2O3 tan
Al2O3 + 2NaOH → H2O + 2NaAlO2
Mg không hiện tượng
Câu 5. Phát biểu nào sau đây về tính chất hóa học nào sau đây của Al(OH)3 là đúng nhất?
A. Không bị phân hủy ở nhiệt độ cao.
B. Không có tính axit.
C. Tính khử.
D. Hiđroxit lưỡng tính.
Lời giải:
Al(OH)3 là Hiđroxit lưỡng tính.
Câu 6. Nhận định nào sau đây sai về tính chất vật lí của nhôm?
A. Nhôm là kim loại nhẹ, dẫn nhiệt tốt.
B. Nhôm là kim loại màu trắng bạc, có ánh kim.
C. Nhôm dẫn điện tốt hơn đồng.
D. Nhôm có tính dẻo dễ kéo sợi.
Lời giải:
A đúng vì nhôm là kim loại nhẹ, dẫn nhiệt tốt.
B đúng vì nhôm là kim loại màu trắng bạc, có ánh kim.
C sai vì nhôm có độ dẫn điện bằng 23 độ dẫn điện đồng (dẫn điện kém hơn đồng).
D đúng nhôm có tính dẻo dễ kéo sợi.
Câu 7. Cho các phản ứng:
(1) Na2S + HCl;
(2) F2+ H2O;
(3) MnO2 + HCl đặc;
(4) Cl2 + dung dịch H2S.
Các phản ứng tạo ra đơn chất là
A. (1), (2), (4).
B. (2), (3), (4).
C. (1), (2), (3).
D. (1), (3), (4).
Lời giải:
(1) Na2S + 2HCl → 2NaCl + H2S
(2) 2F2 + 2H2O → 4HF + O2
(3) MnO2 + 4HCl đặc → MnCl2 + Cl2 + 2H2O
(4) Cl2+ H2S → 2HCl + S
=> các phản ứng tạo ra đơn chất là: (2), (3), (4)
Câu 8. Phát biểu nào sau đây đúng khi nói về nhôm oxit ?
A. Al2O3 được sinh ra khi nhiệt phân muối Al(NO3)3.
B. Al2O3 bị khử bởi CO ở nhiệt độ cao.
C. Al2O3 tan được trong dung dịch NH3.
D. Al2O3 là oxit không tạo muối.
Lời giải:
A đúng 4Al(NO3)3→ 2Al2O3 +12NO2 + 3O2
B sai do CO chỉ khử được oxit của các kim loại đứng sau Al trong dãy điện hóa
C sai do NH3 có tính bazơ yếu nên không hòa tan được Al2O3
D sai do Al2O3 là oxit lưỡng tính, có tạo muối
Câu 9. Cho các phát biểu: (1) Nhôm là một kim loại lưỡng tính; (2) CrO3 là oxit lưỡng tính; (3) Al2O3 là oxit lưỡng tính; Al(OH)3 là hidroxit lưỡng tính. Số phát biểu đúng là
A. 3
B. 2
C. 1
D. 4
Lời giải:
(1) sai, không có khái niệm kim loại lưỡng tính
(2) sai, CrO3 là oxit axit
(3) (4) đúng
Vậy có 2 phát biểu đúng
Câu 10. Hiện tượng xảy ra khi nhỏ vài giọt dung dịch H2SO4 vào dung dịch Na2CrO4 là:
A. Dung dịch chuyển từ màu vàng sang không màu.
B. Dung dịch chuyển từ màu da cam sang màu vàng.
C. Dung dịch chuyển từ màu vàng sang màu da cam.
D. Dung dịch chuyển từ không màu sang màu da cam.
Lời giải:
Cr2O72− + H2O ⇆ 2CrO42− + 2H+
(Da cam) (vàng)
Thêm H2SO4 → [H+] tăng → cân bằng chuyển dịch sang trái → dung dịch chuyển từ màu vàng sang màu da cam.
Xem thêm các phương trình hóa học khác:
Al2(SO4)3 + NaOH→ Al(OH)3 + Na2SO4
AlCl3 + NaOH → NaAlO2 + NaCl + H2O
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
MnO2 + HCl → MnCl2 + Cl2 + H2O
Cr + O2 → Cr2O3
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




