Phản ứng K2CO3 + BaCl2 → KCl + BaCO3
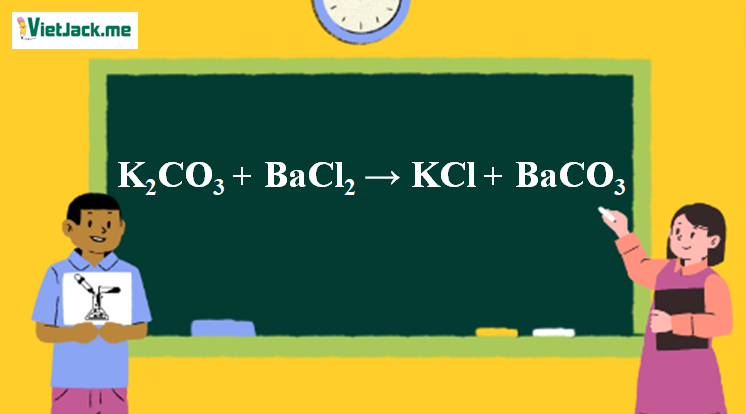
1. Phản ứng hóa học
K2CO3 + BaCl2 → 2KCl + BaCO3(↓)
2. Điều kiện phản ứng
Điều kiện thường.
3. Cách thực hiện phản ứng
Nhỏ dung dịch K2CO3 vào ống nghiệm chứa BaCl2
4. Hiện tượng nhận biết phản ứng
Có kết tủa trắng.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K2CO3 (Kali cacbonat)
K2CO3 là một muối của axit cacbonic và là một muối yếu nên tác dụng với dung dịch muối để tạo muối mới bền vững hơn.
5.2. Bản chất của BaCl2 (Bari clorua)
BaCl2 mang đầy đủ tính chất hóa học của muối tác dụng được với dung dịch muối khác tạo 2 muối mới với điều kiện sản phẩm tạo thành phải có chất khí hoặc chất kết tủa hoặc nước.
6. Tính chất hóa học của K2CO3
Là một muối của axit cacbonic và một muối yếu nên K2CO3 có tính chất sau:
– Tác dụng với axit mạnh hơn để tạo thành muối mới như CH3COOH, H2SO3, HNO3, HCl ….
-
- K2CO3 + 2CH3COOH → 2CH3COOK + CO2↑ + H2O
- K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
– K2CO3 phản ứng với dung dịch kiềm để tạo muối:
-
- K2CO3 + NaOH → Na2CO3 + KOH
– K2CO3 tác dụng với dung dịch muối để tạo muối mới bền vững hơn:
-
- K2CO3 + NaCl → KCl + Na2CO3
– Do là một muối axit yếu nên K2CO3 dễ bị phân hủy ở nhiệt độ cao để giải phóng ra khí cacbonic:
-
- K2CO3 → K2O + CO2
7. Mở rộng kiến thức về BaCl2
7.1. Tính chất vật lí & nhận biết
Tính chất vật lý:
– Là chất rắn, có màu trắng và tan tốt trong nước.
– Có độc tính.
– Đốt cho ngọn lửa màu xanh lá cây sáng.
Nhận biết: Cho vài giọt H2SO4 vào dung dịch, thấy xuất hiện kết tủa trắng, không tan trong axit.
BaCl2 + H2SO4 → BaSO4 + 2HCl
7.2. Tính chất hóa học
Mang tính chất hóa học của muối
Tác dụng với muối:
BaCl2 + 2AgNO3 → 2AgCl + Ba(NO3)2
BaCl2 + CuSO4 → BaSO4 + CuCl2
Tác dụng với axit:
BaCl2 + H2SO4 → BaSO4 + 2HCl
7.3. Điều chế
Điều chế từ bari sunfat:
BaSO4 + 4C –to→ BaS + 4CO
BaS + CaCl2 → BaCl2 + CaS
7.4. Ứng dụng
Barium chloride chủ yếu được sử dụng trong việc tinh chế dung dịch nước muối trong các nhà máy clorua caustic và cũng trong sản xuất muối xử lý nhiệt, thép, trong sản xuất bột màu, và trong sản xuất các muối bari khác.
Hợp chất này cũng được dùng trong pháo hoa để tạo màu xanh lá cây sáng. Tuy nhiên vì tính độc của nó nên đã bị hạn chế ứng dụng.
BaCl2 còn dùng để sản xuất thuốc trừ sâu, thuốc diệt Chuột.
Dùng để xử lý nước : loại bỏ CaSO4 trong nước nồi hơi.
8. Câu hỏi vận dụng
Câu 1. Nhỏ từ từ một vài giọt K2CO3 vào ống nghiệm có chứa 1ml BaCl2 thu được kết tủa có màu
A. trắng. B. đen. C. vàng. D. nâu đỏ.
Lời giải:
K2CO3 + BaCl2 → 2KCl + BaCO3(↓)
BaCO3(↓) trắng
Đáp án A.
Câu 2. Chất nào sau đây không thể phản ứng với K2CO3?
A. BaCl2. B. Ba(OH)2. C. Ba(NO3)2. D, BaCO3.
Lời giải:
BaCO3 không phản ứng với K2CO3.
Đáp án D.
Câu 3. Khối lượng kết tủa thu được khi cho K2CO3 phản ứng vừa đủ với 100ml BaCl2 0,01M là
A. 0,197g. B. 2,17g. C.1,33g. D. 0,217g
Lời giải:
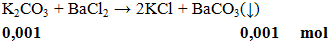
m↓ = 0,001.197 =0,197g
Đáp án A.
Xem thêm các phương trình hóa học khác:
K2CO3 + Ba(NO3)2 → KNO3 + BaCO3
K2CO3 + Ca(NO3)2 → KNO3 + CaCO3
K2CO3 + Cl2 → KCl + KClO + CO2
K2CO3 + AlCl3 + H2O → KCl + Al(OH)3 + CO2
K2S + HCl → KCl + H2S
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




