Phản ứng: NaOH + Al(OH)3 → NaAlO2+ H2O
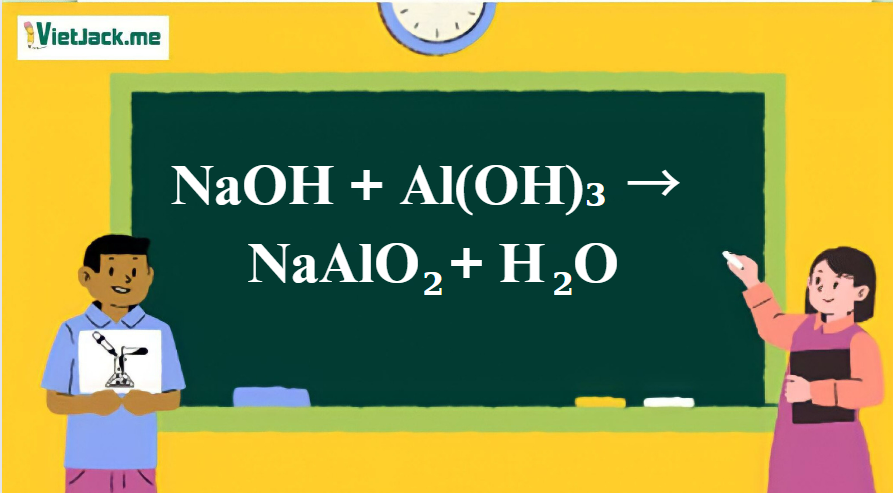
1. Phương trình phản ứng giữa NaOH và Al(OH)3
NaOH + Al(OH)3 → NaAlO2 + 2H2O
2. Điều kiện phản ứng
– Phản ứng xảy ra ngay điều kiện thường.
3. Cách thực hiện phản ứng
– Nhỏ từ từ dung dịch NaOH vào ống nghiệm chứa Al(OH)3
4. Hiện tượng nhận biết phản ứng
– Kết tủa tan dần tạo dung dịch trong suốt.
Bạn có biết:
– Zn(OH)2, Cr(OH)3 cũng tác dụng với NaOH tạo dung dịch.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của NaOH
– Trong phản ứng này, NaOH (Hydroxide natri) là chất kiềm, có tính ăn mòn mạnh và có khả năng tương tác với các axit để tạo thành muối
5.2 Bản chất của Al(OH)3
Al(OH)3 là một hợp chất chất có chức năng như một chất acid
6. Tính chất hóa học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
6.1 Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
6.2 Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
6.3 Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
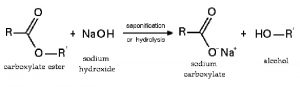
6.4 Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
6.5 Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
6.6 Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
7. Tính chất hóa học của Al(OH)3
7.1 Kém bền với nhiệt: Khi đun nóng Al(OH)3 phân hủy thành Al2O3.
2Al(OH)3 Al2O3 + 3H2O
7.2 Tác dụng với axit mạnh:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
7.3 Tác dụng với dung dịch kiềm mạnh:
Al(OH)3 + KOH → KAlO2+ 2H2O
Al(OH)3 + KOH → K[Al(OH)4]
8. Ứng dụng của Al(OH)3
– Dùng để sản xuất các sản phẩm hóa chất khác: Phèn – Al2(SO4)3, AlCl3, Al2O3, Zeolite, …
– Sản xuất gốm sứ, thủy tinh và sản suất giấy.
– Dùng trong ngành công nghiệp nhựa( sản xuất bao bì), cao su và sơn.
– Sản xuất các sản phẩm thiết bị điện, sản xuất chất kết dính, keo dán, và một số sản phẩm khác.
9. Ví dụ minh họa
Ví dụ 1:
Nhỏ từ từ dung dịch NaOH đến dư vào ống nghiệm chứa Al(NO3)3. Hiện tượng thu được sau phản ứng là
A. xuất hiện kết tủa keo trắng.
B. xuất hiện kết tủa màu nâu đỏ.
C. xuất hiện kết tủa keo trắng, sau đó kết tủa tan.
D. xuất hiện kết tủa keo xanh.
Hướng dẫn giải
3NaOH + Al(NO3)3 → 3NaNO3+ Al(OH)3↓
Al(OH)3: kết tủa keo trắng , sao đó NaOH dư, kết tủa tan theo phương trình:
NAOH + Al(OH)3↓ → KAlO2 (dd)+ 2H2O
Đáp án C.
Ví dụ 2:
Phản ứng nào sau đây không là phản ứng trao đổi?
A. NaOH + Al(OH)3 → NaAlO2+ 2H2O
B. 2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓
C. 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
D. 2KOH + MgSO4 → K2SO4 + Mg(OH)2↓
Hướng dẫn giải
NaOH + Al(OH)3 → NaAlO2+ 2H2O không là phản ứng trao đổi.
Đáp án A.
Ví dụ 3:
Số mol NaOH cần dung để phản ứng hoàn toàn với 0,78g Al(OH)3 là
A. 0,001. B. 0,01. C. 0,1. D. 1.
Hướng dẫn giải
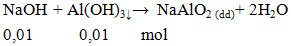
Đáp án B.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




