Phản ứng Fe + H2SO4 (loãng) → FeSO4 + H2
1. Phương trình phản ứng
Fe + H2SO4 loãng → FeSO4 + H2
2. Điều kiện phản ứng
– Dung dịch H2SO4 loãng.
3. Cách thực hiện phản ứng
Cho kim loại sắt tác dụng với dung dịch axit sunfric loãng
4. Hiện tượng nhận biết phản ứng
Kim loại tan dần tạo thành dung dịch màu xanh nhạt và có hiện tượng sủi bọt khí
5. Bạn có biết
Các kim loại đứng trước H trong dãy hoạt động hóa học đều tham gia phản ứng với H2SO4 loãng tạo muối và khí H2
6. Tính chất hóa học của Sắt
Sắt là kim loại có tính khử trung bình. Khi tác dụng với chất oxi hóa yếu, sắt bị oxi hóa đến số oxi hóa +2.
Fe → Fe+2+ 2e
Với chất oxi hóa mạnh, sắt bị oxi hóa đến số oxi hóa +3.
Fe → Fe+3 + 3e
6.1. Tác dụng với phi kim
Ở nhiệt độ cao, sắt khử nguyên tử phi kim thành ion âm và bị oxi hóa đến số oxi hóa +2 hoặc +3.
+ Tác dụng với lưu huỳnh: Fe0+S0→toFe+2S−2
+ Tác dụng với oxi: 3Fe+2O20→toFe3O−24

+ Tác dụng với clo: 2Fe0+3Cl20→to2Fe+3Cl−13
6.2. Tác dụng với axit
– Với dung dịch HCl, H2SO4 loãng, Fe bị oxi hóa đến số oxi hóa +2, giải phóng H2. Ví dụ:
Fe + H2SO4 → FeSO4 + H2
– Với dung dịch HNO3 và H2SO4 đặc nóng, Fe bị oxi hóa đến số oxi hóa +3, và không giải phóng H2. Ví dụ:
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
Chú ý: Fe bị thụ động bởi các axit HNO3 đặc, nguội và H2SO4 đặc, nguội.
6.3. Tác dụng với dung dịch muối
Fe có thể khử được ion của các kim loại đứng sau nó trong trong dãy điện hóa của kim loại. Trong các phản ứng này, Fe thường bị oxi hóa đến số oxi hóa +2. Ví dụ:
Fe + CuSO4 → FeSO4 + Cu
Đặc biệt:
Fe + 2Ag+ → Fe2+ + 2Ag
Nếu Ag+ dư, tiếp tục có phản ứng:
Fe2+ + Ag+ → Fe3+ + Ag
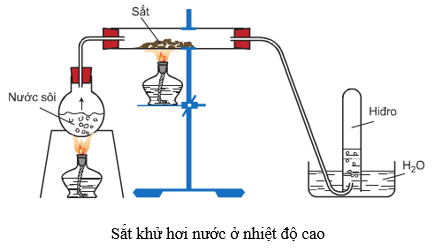
6.4. Tác dụng với nước
Ở nhiệt độ thường, sắt không khử được nước, nhưng ở nhiệt độ cao, sắt khử hơi nước tạo ra H2 và Fe3O4 hoặc FeO.
3Fe + 4H2O →to<570oC Fe3O4 + 4H2
Fe + H2O →to>570oC FeO + H2
7. Bài tập vận dụng
Câu 1. Cho các kim loại sau: Cu; Au; Zn; K; Fe; Kim loại nào tác dụng được với dung dịch H2SO4 loãng?
A. Cu; Zn; Fe B. Au; K; Fe; Zn
C. Zn; Fe D. Zn; Fe; K
Hướng dẫn giải
Đáp án D
Zn; Fe; K là các kim loại đứng trước H trong dãy hoạt động hóa học nên phản ứng được với dung dịch H2SO4 loãng.
Câu 2. Cho các chất sau: CaCO3; Ag; PbO; CuS; K2S; Fe. Số chất tác dụng với dung dịch H2SO4 loãng có tạo sản phẩm là khí là:
A. 3 B. 4 C. 5 D. 2
Hướng dẫn giải
Đáp án A
CaCO3 + H2SO2 → CaSO4 + CO2 + H2O
K2S + H2SO4 → K2SO4 + H2S
Fe + H2SO4 → FeSO4 + H2
Câu 3. Khi cho sắt tác dụng với dụng dịch H2SO4 loãng dư hiện tượng xảy ra là gì? Chọn đáp án đúng nhất
A. Dung dịch chuyển từ không màu sang màu xanh nhạt
B. Dung dịch chuyển từ không màu xanh nhạt và có khí không màu thoát ra.
C. Kim loại tan dần tạo thành dung dịch màu xanh nhạt và có hiện tượng sủi bọt khí.
D. Kim loại tan dần tạo thành dung dịch màu xanh nhạt.
Hướng dẫn giải
Đáp án C
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




