Phản ứng K + CuCl2 + H2O → KCl + H2 + Cu(OH)2
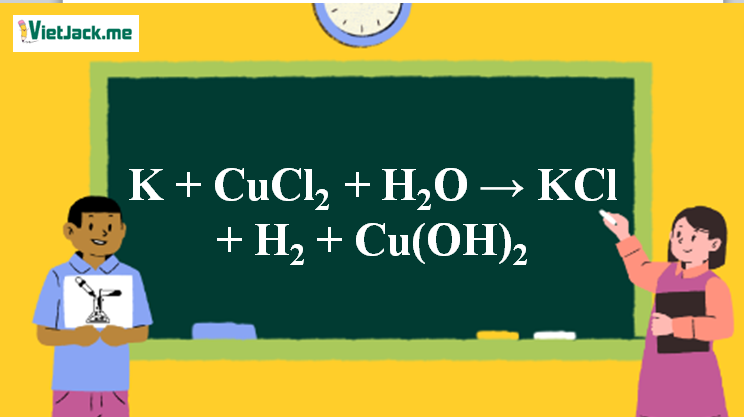
1. Phản ứng hóa học
2K + CuCl2 + 2H2O → 2KCl + H2 + Cu(OH)2
2. Điều kiện phản ứng
Không cần điều kiện.
3. Cách thực hiện phản ứng
Cho kali tác dụng với dung dịch muối đồng clorua.
4. Hiện tượng nhận biết phản ứng
Kali tan dần trong dung dịch muối đồng clorua, có kết tủa màu xanh tạo thành và có khí thoát ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K (Kali)
– Trong phản ứng trên K là chất khử.
– K là chất khử mạnh, K tham gia phản ứng với các dung dịch muối sẽ tham gia phản ứng với nước trước tạo hidroxit và giải phóng H2.
5.2. Bản chất của CuCl2 (Đồng clorua)
CuCl2 mang tính chất hoá học của muối tác dụng được với dung dịch kiềm.
6. Tính chất hoá học của K
Kali là kim loại kiềm có tính khử rất mạnh.
K → K+ + 1e
6.1. Tác dụng với phi kim
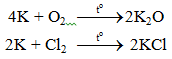
6.2. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
6.3. Tác dụng với nước
K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
6.4. Tác dụng với hidro
Kali tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
7. Mở rộng kiến thức về CuCl2
7.1. Tính chất vật lí và nhận biết
– Tính chất vật lí: Là chất rắn, màu nâu nhạt, tan tốt trong nước. Hút ẩm tốt, khi có mặt nước chuyển sang màu xanh nhạt.
– Nhận biết: Dùng dung dịch AgNO3, sau phản ứng thu được dung dịch có màu xanh và xuất hiện kết tủa trắng.
AgNO3 + CuCl2 → Cu(NO3)2 + 2AgCl
7.2. Tính chất hóa học
Có tính chất hóa học của muối.
a. Tác dụng với dung dịch bazơ:
CuCl2 + 2NaOH → Cu(OH)4 + 2NaCl
CuCl2 + Ba(OH)2 → Cu(OH)4 + BaCl4
b. Tác dụng với muối:
AgNO3 + CuCl2 → Cu(NO3)2 + 2AgCl
7.3. Điều chế
Đồng (II) clorua điều chế bằng việc đốt cháy đồng trong clo
Cu + Cl2 → CuCl2
7.4. Ứng dụng
– Chất xúc tác hóa học
CuCl2 hoạt động như một chất xúc tác trong các phản ứng hóa học khác nhau. Nó tăng tốc phản ứng bằng cách cung cấp một phản ứng thay thế với năng lượng kích hoạt thấp hơn. Vai trò này rất quan trọng trong quá trình tổng hợp các hợp chất hữu cơ và dược phẩm.
– Mạ điện
Ngành xi mạ điện sử dụng CuCl2 trong quá trình mạ điện kim loại lên bề mặt. Nó giúp đạt được các lớp phủ đồng nhất và bền trên các vật thể, tăng cường vẻ ngoài và khả năng chống ăn mòn của chúng.
– Ngành dệt may
CuCl2 được sử dụng trong quá trình nhuộm vải. Nó tăng cường khả năng hấp thụ thuốc nhuộm, cải thiện độ bền màu và đảm bảo phân phối thuốc nhuộm đồng đều, giúp vải có màu rực rỡ và lâu trôi.
– Nông nghiệp
Trong nông nghiệp, CuCl2 được sử dụng làm chất vi lượng trong phân bón để giải quyết tình trạng thiếu đồng trong đất. Nó thúc đẩy sự phát triển của cây khỏe mạnh, hỗ trợ quá trình quang hợp và tăng cường sức đề kháng của cây đối với bệnh tật.
– Bảo quản gỗ
Bảo quản gỗ là một lĩnh vực khác mà CuCl2 hữu ích. Gỗ được xử lý trở nên có khả năng chống côn trùng và nấm cao hơn, kéo dài tuổi thọ và giảm nhu cầu thay thế liên tục.
– Khử lưu huỳnh
CuCl2 được sử dụng trong quá trình khử lưu huỳnh để loại bỏ các hợp chất lưu huỳnh khỏi khí công nghiệp. Điều này rất quan trọng để giảm ô nhiễm không khí và giảm thiểu phát thải khí độc hại.
8. Câu hỏi vận dụng
Câu 1. Khi cho kim loại K vào dung dịch CuCl2 thì sẽ xảy ra hiện tượng
A. ban đầu có xuất hiện kết tủa xanh, sau đó kết tủa tan ra, dung dịch trong suốt.
B. ban đầu có sủi bọt khí, sau đó xuất hiện kết tủa xanh.
C. ban đầu có sủi bọt khí, sau đó có tạo kết tủa xanh, rồi kết tủa tan ra, dd trong suốt.
D. chỉ có sủi bọt khí.
Lời giải:
Đáp án B
Phương trình hóa học: 2K + CuCl2 + 2H2O → 2KCl + H2 + Cu(OH)2
Câu 2. Cho K tác dụng với các dung dịch sau: NaCl; H2O; HCl; CuCl2; Na2CO3.
Số phản ứng xảy ra tạo thành kết tủa là
A. 1 B. 2
C. 3 D. 4
Lời giải:
Đáp án A
Phương trình hóa học: 2K + CuCl2 + 2H2O → 2KCl + H2 + Cu(OH)2
Câu 3. Cho kim loại 1,15 g Na tác dụng với dung dịch CuCl2 thu được m g muối.
Giá trị của m là:
A. 3,725 g B. 7,45g
C. 0,745 g D. 0,3725 g
Lời giải:
Đáp án A
Phương trình phản ứng: 2K + CuCl2 + 2H2O → 2KCl + H2 + Cu(OH)2
nKCl = nK = 0,05 mol ⇒ mKCl = 0,05.74,5 = 3,725 g
Xem thêm các phương trình phản ứng hóa học khác:
K + FeCl2 + H2O → KCl + H2 + Fe(OH)2
K + AlCl3 + H2O → KCl + H2 + Al(OH)3
K + ZnCl2 + 2H2O → KCl + H2 + Zn(OH)2
K + FeCl3 + H2O → KCl + H2 + Fe(OH)3
K + Cr2(SO4)3 + H2O → K2SO4 + H2 + Cr(OH)3
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




