Phản ứng KOH + FeSO4 → K2SO4 + Fe(OH)2
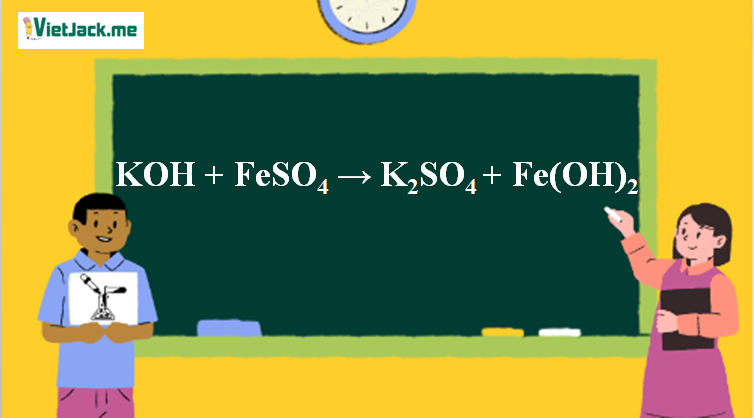
1. Phản ứng hóa học
2KOH + FeSO4 → K2SO4 + Fe(OH)2
2. Điều kiện phản ứng
Phản ứng xảy ra ngay điều kiện thường.
3. Cách thực hiện phản ứng
Nhỏ từ từ dung dịch KOH vào ống nghiệm chứa FeSO4.
4. Hiện tượng nhận biết phản ứng
Sau phản ứng thu được kết tủa màu trắng xanh, để một thời gian trong không khí kết tủa chuyển sang màu nâu đỏ.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của KOH (Kali hidroxit)
KOH là một bazo mạnh tác dụng với muối để tạo thành muối mới và axit mới.
5.2. Bản chất của FeSO4 (Sắt (II) sunfat)
FeSO4 mang tính chất hoá học của muối tác dụng được với dung dịch bazo như KOH tạo kết tủa.
6. Tính chất hoá học của KOH
KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
6.1. Tác dụng với oxit axit
Ở điều kiện nhiệt độ phòng, KOH tác dụng với SO2, CO2,…
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
6.2. Tác dụng với axit
-
Tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
-
Tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
6.3. Tác dụng với kim loại
KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới.
KOH + Na → NaOH + K
6.4. Tác dụng với muối
KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
6.5. KOH điện li mạnh
KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion K+ và OH-
6.6. KOH phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính
KOH phản ứng được với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
6.7. Phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
7. Mở rộng kiến thức về FeSO4
7.1. Tính chất vật lí và nhận biết
– Tính chất vật lý: Có khả năng hút ẩm tốt, thường tồn tại ở trạng thái ngậm nước. Tan tốt trong nước cho dung dịch không màu.
– Nhận biết: Sử dụng dung dịch BaCl2, thấy xuất hiện kết tủa trắng:
FeSO4 + BaCl2 → BaSO4 + FeCl2.
7.2. Tính chất hóa học
– Mang đầy đủ tính chất hóa học của muối.
– Có tính khử và tính oxi hóa:
Tính khử: Fe2+ → Fe3+ + 1e
Tính oxi hóa: Fe2+ + 1e → Fe
a. Tính chất hóa học của muối:
– Tác dụng với dung dịch kiềm:
FeSO4 + KOH → K2SO4 + Fe(OH)2
– Tác dụng với muối:
FeSO4 + BaCl2 → BaSO4 + FeCl2.
b. Tính khử:
FeSO4 + Cl2 → FeCl3 +Fe2(SO4)3
2FeSO4 + 2H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + 2H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
c. Tính oxi hóa:
FeSO4 + Mg → MgSO4 + Fe
7.3. Điều chế
Cho kim loại Fe dư tác dụng với axit HNO3
3Fe + 8HNO3 → 4H2O + 2NO + 3Fe(NO3)2
7.4. Ứng dụng
FESO4 – sắt sunfat mang tính chất là một chất khử nên được ứng dụng trong việc khử cromat trong xi măng thành các hợp chất Cr (III) ít độc hơn. FeSO4 – sắt sunfat còn được sử dụng trong ngành dệt may như một chất cố định thuốc nhuộm . Nó được sử dụng trong lịch sử để làm đen da và như là một thành phần của mực.
8. Câu hỏi vận dụng
Câu 1. Nhỏ từ từ dung dịch KOH vào ống nghiệm chứa FeSO4. Hiện tượng thu được sau phản ứng là
A. xuất hiện kết tủa trắng.
B. xuất hiện kết tủa trắng xanh, sau một thời gian kết tủa chuyển sang màu nâu đỏ.
C. xuất hiện kết tủa sau đó kết tủa tan.
D. xuất hiện kết tủa xanh.
Lời giải:
2KOH + FeSO4 → K2SO4+ Fe(OH)2
Fe(OH)2: kết tủa trắng xanh.
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 ( nâu đỏ)
Đáp án B.
Câu 2. Phản ứng nào sau đây là phản ứng trao đổi?
A. KOH + CO2 → KHCO3
B. 2KOH + CO2 → K2CO3+ H2O
C. 2K + 2HCl → 2KCl + H2
D. 2KOH + FeSO4 → K2SO4 + Fe(OH)2
Lời giải:
2KOH + FeSO4 → K2SO4 + Fe(OH)2 là phản ứng trao đổi.
Đáp án D.
Câu 3. Cho 100ml FeSO4 0,01M phản ứng vừa đủ với dung dịch KOH thu được kết tủa X. lấy kết tủa X đem nung trong không khí đến khi khối lượng không thay đổi thu được chất rắn có khối lượng là
A. 0,08g. B. 0,8g. C. 0,754g. D. 1,10g.
Lời giải:
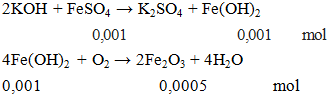
mcr = 0,0005.160 = 0,08gam.
Đáp án A.
Xem thêm các phương trình hóa học khác:
KOH + Mg(NO3)2 → KNO3+ Mg(OH)2
KOH + Al(OH)3 → KAlO2 + H2O
KOH + Cr(OH)3 → KCrO2+ H2O
KOH + Zn(OH)2 → K2ZnO2 + H2O
KOH + KHCO3 → K2CO3 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




