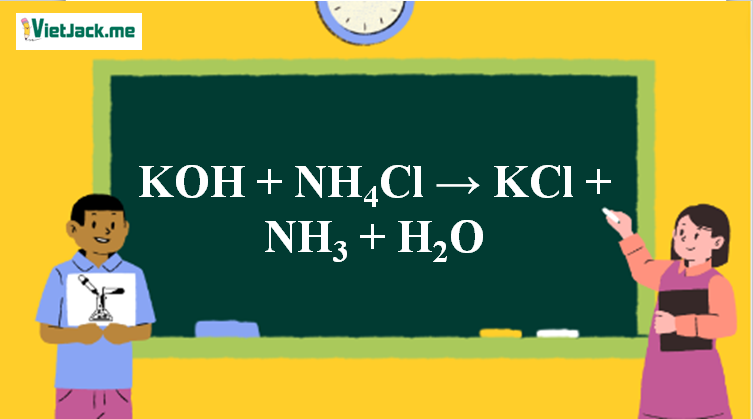
Phản ứng KOH + NH4Cl →to KCl + NH3 + H2O
1. Phản ứng hóa học
KOH + NH4Cl →to KCl + NH3 + H2O
2. Điều kiện phản ứng
Phản ứng xảy ra khi đun nóng.
3. Cách thực hiện phản ứng
Đun nóng muối NH4Cl với KOH.
4. Hiện tượng nhận biết phản ứng
Có khí không màu, mùi khai bay ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của KOH (Kali hidroxit)
KOH là một bazo mạnh phản ứng với muối NH4Cl khi đun nóng và có khí mùi khai bay ra.
5.2. Bản chất của NH4Cl (Amoni clorua)
Amoni clorua là muối của axit yếu nên có khả năng phản ứng với bazo mạnh như NaOH, KOH, … để giải phóng khí amoniac.
6. Tính chất hoá học của KOH
KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
6.1. Tác dụng với oxit axit
Ở điều kiện nhiệt độ phòng, KOH tác dụng với SO2, CO2,…
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
6.2. Tác dụng với axit
-
Tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
-
Tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
6.3. Tác dụng với kim loại
KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới.
KOH + Na → NaOH + K
6.4. Tác dụng với muối
KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
6.5. KOH điện li mạnh
KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion K+ và OH-
6.6. KOH phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính
KOH phản ứng được với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
6.7. Phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
7. Tính chất vật lý của KOH
– Khối lượng riêng: 2.044 g/cm3
– Độ pH: 13
– Nhiệt độ sôi: 1.327oC (1.6000 K; 2.421 oF)
– Nhiệt độ nóng chảy: 406 oC (679 K; 763 oF)
– Độ hòa tan trong nước:7 g/ml (0 oC); 121 g/ml (25 oC); 178 g/ml (100 oC)
– Khả năng hòa tan chất khác: có thể được hòa tan trong alcohol, glycerol và không tan được trong ether.
8. Tính chất hoá học của muối amoni
8.1. Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
8.2. Tác dụng với dung dịch kiềm
(nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
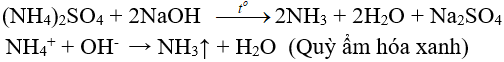
8.3. Phản ứng nhiệt phân
– Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
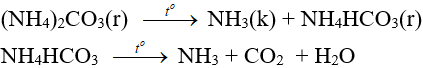
NH4HCO3 (bột nở) được dùng làm xốp bánh.
– Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
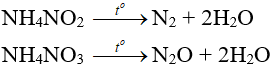
– Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
9. Câu hỏi vận dụng
Câu 1. Muối nào sau đây phản ứng với KOH không thu được amoniac?
A. NH4Cl. B. NH4NO3. C. (NH4)2SO4 . D. NaNO3.
Lời giải:
NaNO3 không phản ứng với KOH.
Đáp án D.
Câu 2. Hiện tượng xảy ra khi đun nóng muối NH4Cl với KOH là
A. Có khí màu nâu đỏ bay ra.
B. Có khí mùi trứng thối thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Có khí mùi khai thoát ra.
Lời giải:
KOH + NH4Cl 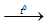 KCl+ NH3 + H2O
KCl+ NH3 + H2O
NH3 là khí có mùi khai.
Đáp án D.
Câu 3. Cho dung dịch KOH dư vào 100 ml NH4Cl 1 ml đun nóng nhẹ. Thể tích khí ở đktc thu được là
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít
Lời giải:
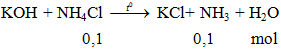
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Xem thêm các phương trình hóa học khác:
KOH + NH4NO3 → KNO3 + NH3 + H2O
KOH + (NH4)2SO4 → K2SO4 + NH3 + H2O
CH3COOCH3 + KOH → CH3COOK + CH3OH
CH3COOC2H5 + KOH → CH3COOK + C2H5OH
C2H5Cl + KOH → KCl + C2H5OH
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




