Phản ứng KOH + NaHCO3 → K2CO3 + Na2CO3 + H2O
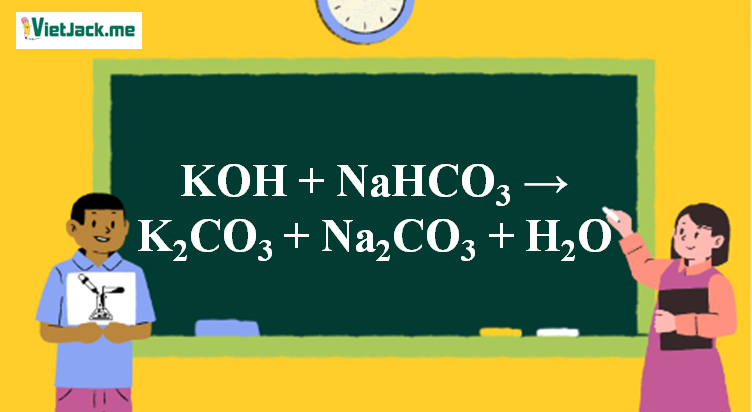
1. Phản ứng hóa học
2KOH + 2NaHCO3 → K2CO3 + Na2CO3 + 2H2O
2. Điều kiện phản ứng
Điều kiện thường.
3. Cách thực hiện phản ứng
Nhỏ từ từ KOH vào ống nghiệm có chứa NaHCO3.
4. Hiện tượng nhận biết phản ứng
Sản phẩm tạo thành tạo kết tủa trắng với muối của Bari.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của NaHCO3 (Natri hidrocacbonat)
NaHCO3 là hợp chất lưỡng tính tác dụng được với các dung dịch kiềm.
5.2. Bản chất của KOH (Kali hidroxit)
KOH là bazo mạnh có thể phản ứng với muối hidro cacbonat để thu được muối cacbonat.
6. Tính chất hoá học của KOH
KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
6.1. Tác dụng với oxit axit
Ở điều kiện nhiệt độ phòng, KOH tác dụng với SO2, CO2,…
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
6.2. Tác dụng với axit
-
Tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
-
Tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
6.3. Tác dụng với kim loại
KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới.
KOH + Na → NaOH + K
6.4. Tác dụng với muối
KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
6.5. KOH điện li mạnh
KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion K+ và OH-
6.6. KOH phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính
KOH phản ứng được với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
6.7. Phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
7. Tính chất vật lý của KOH
– Khối lượng riêng: 2.044 g/cm3
– Độ pH: 13
– Nhiệt độ sôi: 1.327oC (1.6000 K; 2.421 oF)
– Nhiệt độ nóng chảy: 406 oC (679 K; 763 oF)
– Độ hòa tan trong nước:7 g/ml (0 oC); 121 g/ml (25 oC); 178 g/ml (100 oC)
– Khả năng hòa tan chất khác: có thể được hòa tan trong alcohol, glycerol và không tan được trong ether.
8. Tính chất hóa học của NaHCO3
– NaHCO3 bị thủy phân trong dung dịch nước tạo thành môi trường bazơ yếu có thể đổi màu quỳ tím.
NaHCO3 + H2O → NaOH + H2CO3
– Tác dụng với axit mạnh hơn tạo ra muối và nước đồng thời giải phóng khí CO2
2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2
– Tác dụng với bazơ tạo muối mới và bazơ mới
NaHCO3 + Ca(OH)2 → CaCO3 + NaOH + H2O
Hoặc cũng có thể tạo ra hai muối mới
2NaHCO3 + Ca(OH)2 → CaCO3 + Na2CO3 + 2H2O
– Tác dụng với NaOH tạo ra muối trung hòa và nước
NaHCO3 + NaOH → Na2CO3 + H2O
9. Câu hỏi vận dụng
Câu 1. KOH không phản ứng với dung dịch nào sau đây?
A. KHCO3. B. NaHSO3. C. Na2CO3. D. H2S.
Lời giải:
Na2CO3 không phản ứng với KOH.
Đáp án C.
Câu 2. Dẫn từ từ đến dư CO2 vào dung dịch KOH thu được dung dịch X. Muối tan có trong dung dịch X là
A. K2S. B. K2S và KHS. C. KHCO3. D. K2CO3 và KOH.
Lời giải:
Do CO2 dư nên có phản ứng
KOH + CO3 → KHSO3
Muối tan có trong dung dịch X là KHCO3.
Đáp án C.
Câu 3. Cho 0,56g KOH hòa tan vào nước được dung dịch X. Lượng dung dịch X trên phản ứng vừa đủ với dung dịch NaHCO3. Khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 1,58 gam. B, 1,22 gam. C. 0,78 gam. D. 1,26 gam.
Lời giải:
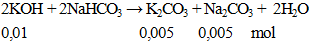
khối lượng muối = 0,005 (138 + 106) = 1,22 gam.
Đáp án B.
Xem thêm các phương trình hóa học khác:
K2CO3 + HBr → KBr + CO2 + H2O
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
K2CO3 + HNO3 → KNO3 + CO2 + H2O
K2CO3 + Ba(OH)2 → KOH + BaCO3
K2CO3 + Ca(OH)2 → KOH + CaCO3
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




