Phản ứng: Cu(NO3)2 + H2O → Cu + HNO3 + O2 ↑
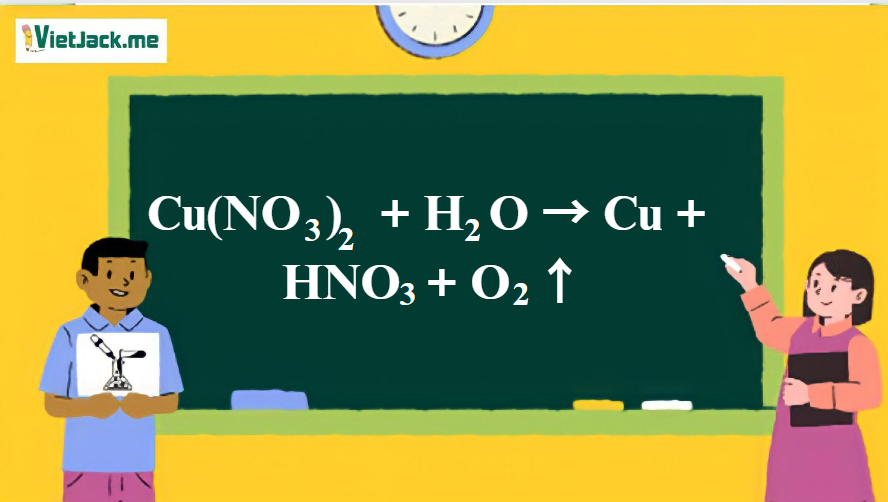
1. Phương trình phản ứng giữa Cu(NO3)2 và H2O
Cu(NO3)2 + H2O → Cu + 2HNO3 + 1/2 O2
2. Điều kiện phản ứng
– Điều kiện khác: Điện phân dung dịch
3. Cách thực hiện phản ứng
– Điện phân dung dịch Cu(NO3)2.
4. Hiện tượng nhận biết phản ứng
– Thu được chất rắn màu đỏ và có khí thoát ra ở anot.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của Cu(NO3)2
– Cu(NO3)2 mang tính chất hóa học của muối
5.2 Bản chất của H2O
– Các phân tử nước tạo thành liên kết hidro với các ion NO3- để tạo thành các phân tử hydrat hóa.
6. Tính chất hóa học của Cu(NO3)2
– Có tính chất hóa học của muối.
Tác dụng với dung dịch bazơ:
Cu(NO3)2 + 2KOH → Cu(OH)2 + 2KCl
Cu(NO3)2 + Ba(OH)2 → Cu(OH)2 + Ba(NO3)2
7. Điều chế Cu(NO3)2
Cho kim loại đồng tác dụng với dung dịch HNO3
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO +4H2O
8. Tính chất hóa học của H2O
8.1 Nước tác dụng với kim loại
- Các kim loại tính kiềm mạnh như Li, Na, K, Ba, Ca… tác dụng với nước dễ dàng ở nhiệt độ thường tạo thành dung dịch bazơ và khí H2: H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
Ví dụ:
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
- Kim loại Mg tan rất chậm trong nước nóng
- Một số kim loại trung bình như Mg, Al, Zn, Fe…phản ứng được với hơi nước ở nhiệt độ cao tạo oxit kim loại và hiđro
Ví dụ:
Mg + H2Ohơi MgO + H2
3Fe + 4H2Ohơi Fe3O4+ 4H2
Fe + H2Ohơi FeO + H2
8.2 Nước tác dụng với oxit bazo
Nước tác dụng với oxit bazơ tạo thành dung dịch bazo tương ứng.
H2O + Oxit bazơ→ Bazơ
Na2O + H2O → 2NaOH
Li2O +H2O→ 2LiOH
K2O +H2O→ 2KOH
CaO + H2O → Ca(OH)2
8.3 Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng.
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
Ngoài ra, H2O còn tham giá rất nhiều phản ứng với các chất khác
Phản ứng với phi kim mạnh: Flo, Clo
Khi gặp H2O khi đun nóng thì flo bốc cháy
2F2 + 2H2O → 4HF + O2
2H2O + 2Cl2 4HCl + O2
Một số phản ứng với muối natri aluminat.
3H2O + 2AlCl3 + 3Na2SO3 6NaCl + 2Al(OH)3 + 3SO2
H2O + NaAlO2 NaAl(OH)4
2H2O + NaAlO2 + CO2 Al(OH)3 + NaHCO3
9. Bạn có biết
– Tương tự CuSO4 khi điện phân cũng thu được chất rắn màu đỏ và có khí thoát ra ở anot.
10. Ví dụ minh họa
Ví dụ 1: Sau một thời gian điện phân dung dịch Cu(NO3)2 với điện cực trơ, khối lượng dung dịch giảm 6,4 gam. Khối lượng Cu thu được ở catot là:
A. 5,12 gam B. 6,4 gam
C. 5,688 gam D. 10,24gam
Đáp án A
Hướng dẫn giải:
Cu(NO3)2 (x mol) + H2O → Cu + 2HNO3 (x mol) + 1/2 O2 ↑ (x/2 mol)
mgiảm = mCu + mO2 = 64x + 16x = 6,4g
⇒ x = 0,08 mol ⇒ mCu = 5,12g.
Ví dụ 2: Sản phẩm thu được khi điện phân dung dịch Cu(NO3)2 (màng ngăn điện cực trơ) là:
A. Cu, O2 và HNO3
B. CuO, H2 và NO2
C. Cu, NO2 và H2
D. CuO, NO2 và O2
Đáp án A
Ví dụ 3: Khi điện phân dung dịch Cu(NO3)2 thì tại anot xảy ra:
A. Sự khử các phân tử H2O.
B. Sự oxi hóa các ion Cu2+.
C. Sự oxi hóa các phân tử H2O.
D. Sự khử các ion Cu2+.
Đáp án C
Hướng dẫn giải:
Anot (+) xảy ra sự oxi hóa.
Có NO3–, H2O.
Do NO3– không bị điện phân nên H2O sẽ bị OXH.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




