Phản ứng: Ba(HCO3)2 + Na2CO3 → NaHCO3 + BaCO3
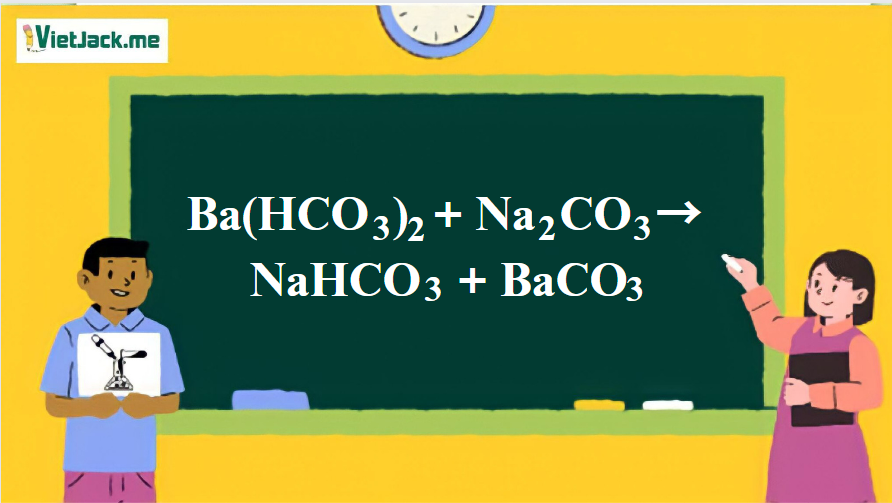
1. Phương trình phản ứng Ba(HCO3)2 tác dụng với Na2CO3
Ba(HCO3)2 + Na2CO3 → 2NaHCO3 + BaCO3↓
2. Hiện tượng của phản ứng Ba(HCO3)2 tác dụng với Na2CO3
–Có xuất hiện kết tủa trắng, kết tủa là BaCO3.
3. Cách tiến hành phản ứng Ba(HCO3)2 tác dụng với Na2CO3
– Cho 1 – 2 mL dung dịch Ba(HCO3)2 vào ống nghiệm chứa 1 – 2 mL dung dịch Na2CO3.
4. Bản chất của các chất tham gia phản ứng
4.1 Bản chất của Ba(HCO3)2
Ba(HCO3)2 trong phản ứng trên là muối của axit carbonic (H2CO3) và kim loại Ba
4.2 Bản chất của Na2CO3
bản chất của Na2CO3 trong phản ứng này là một muối của axit carbonic tham gia vào quá trình phản ứng để tạo ra các sản phẩm mới.
5. Mở rộng về phản ứng trao đổi trong dung dịch chất điện li
Xét phản ứng:
Dung dịch A + dung dịch B → Sản phẩm.
– Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
– Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất 1 trong số các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
Thí dụ:
+ Phản ứng tạo thành chất kết tủa:
K2SO4 + BaCl2 → 2KCl + BaSO4↓
+ Phản ứng tạo thành chất điện li yếu:
HCl + KOH → KCl + H2O
+ Phản ứng tạo thành chất khí:
Zn + H2SO4 loãng → ZnSO4 + H2↑
6. Tính chất hóa học của Na2CO3
6.1 Tác dụng với axit
Thí dụ:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
HCO3− + H+ → CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CO32− + 2H+ → CO2↑ + H2O
6.2 Tác dụng với dung dịch kiềm
– Các muối hiđrocacbonat tác dụng dễ dàng với dung dịch kiềm.
Thí dụ:
NaHCO3 + NaOH → Na2CO3 + H2O
HCO3−+OH−→CO32−+H2O
6.3 Phản ứng nhiệt phân
– Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân:
MgCO3 →to MgO + CO2↑
– Tất cả các muối hiđrocacbonat đều bị nhiệt phân:
2NaHCO3 → Na2CO3 + CO2↑ + H2O
Ca(HCO3)2 → CaCO3 + H2O + CO2↑
7. Tính chất hóa học của Ba(HCO3)2
– Tác dụng với axit mạnh
Ba(HCO3)2 + H2SO4 → BaSO4 + 2H2O + 2CO2
– Tác dụng với dung dịch bazơ
Ba(HCO3)2 + Ca(OH)2 → 2BaCO3 + 2H2O
Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O
– Bị phân hủy bởi nhiệt độ:
Ba(HCO3)2 → BaCO3 + H2O + CO2 (to)
– Phản ứng trao đổi CO32–, PO43–
Ba2+ + CO32– → BaCO3↓
3Ba2+ + 2PO43– → Ba3(PO4)2 ↓
8. Bài tập vận dụng liên quan
Câu 1: Nung 13,4g hỗn hợp muối cacbonat của hai kim loại hóa trị II. Sau khi phản ứng xảy ra hoàn toàn thu được 6,8g chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch NaOH 1M. Khối lượng muối khan thu được sau phản ứng là:
A. 4,2g.
B. 5,8g.
C. 6,3g.
D. 6,5g.
Hướng dẫn giải:
Đáp án C
Gọi công thức chung của hai muối cacbonat là RCO3.
RCO3 →to RO + CO2↑
mCO2=13,4–6,8=6,6gam→nCO2=0,15mol
nNaOH=0,075molnNaOHnCO2=0,5<1
→ Tạo muối axit, NaOH hết.
CO2 + NaOH → NaHCO3
→ nmuối = nNaOH = 0,075 mol
→ mmuối = 0,075.84 = 6,3 gam
Câu 2: Để tạo xốp cho một số loại bánh, có thể dùng muối nào sau đây?
A. (NH4)3PO4.
B. NH4HCO3.
C. CaCO3.
D. NaCl.
Hướng dẫn giải:
Đáp án B
NH4HCO3 →to NH3↑ + CO2↑ + H2O
Khi sử dụng bột nở này, khí NH3 và CO2 thoát ra làm cho bánh căng phồng và xốp.
Câu 3: Cặp chất nào sau đây không bị nhiệt phân?
A. CaCO3, BaCO3.
B. Ca(HCO3)2, Ba(HCO3)2.
C. Na2CO3, K2CO3.
D. NaHCO3, KHCO3.
Hướng dẫn giải:
Đáp án C
Muối cacbonat của kim loại kiềm bền với nhiệt.
Câu 4: Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dung dịch Ca(OH)2 0,05M được kết tủa X và dung dịch Y. Khi đó khối lượng dung dịch Y so với khối lượng dung dịch Ca(OH)2 ban đầu sẽ là:
A. tăng 3,04g.
B. tăng 7,04g.
C. giảm 3,04g.
D. giảm 7,04g.
Hướng dẫn giải:
Đáp án A
nCO2=0,16mol;nCa(OH)2=0,1mol→1<nCO2nCa(OH)2=1,6<2
→ Dung dịch Y chỉ có muối Ca(HCO3)2 và kết tủa X là CaCO3
→n↓=nOH−−nCO2=0,1.2−0,16=0,04mol
→m↓=0,04.100=4gam
mCO2=0,16.44=7,04gam>m↓
→ Dung dịch sau phản ứng tăng 3,04 gam.
Câu 5: Hình vẽ sau đây mô tả thí nghiệm điều chế và thu khí Y từ hỗn hợp rắn gồm CaCO3 và CaSO3:
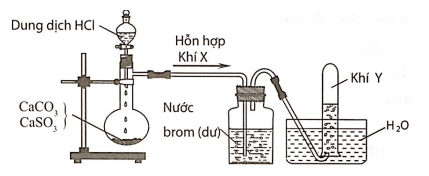
Khí Y là
A. CO2.
B. SO2.
C. H2.
D. Cl2.
Hướng dẫn giải:
Đáp án A
Hỗn hợp khí X gồm CO2 và SO2. Khí SO2 khi đi qua bình đựng nước brom đã bị giữ lại, còn khí Y thoát ra là CO2.
CaCO3→t0CaO+CO2
CaSO3→t0CaO+SO2
SO2+Br2+2H2O→2HBr+H2SO4
Câu 6: Tro thực vật được sử dụng như một loại phân bón cung cấp nguyên tố kali cho cây trồng do chứa muối kali cacbonat. Công thức của kali cacbonat là
A. KCl.
B. KOH.
C. NaCl
D. K2CO3
Hướng dẫn giải:
Đáp án D
Công thức của kali cacbonat là K2CO3.
Câu 7: Chất nào sau đây tác dụng với dung dịch NaHCO3 sinh ra khí CO2?
A. NaCl.
B. KNO3.
C. KCl.
D. HCl.
Hướng dẫn giải:
Đáp án D
HCl + NaHCO3 → CO2↑ + NaCl + H2O
Câu 8: Cho 10 gam CaCO3 vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được V lít CO2 (đktc). Giá trị của V là
A. 2,80.
B. 2,24.
C. 1,12.
D. 3,36.
Hướng dẫn giải:
Đáp án B
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bảo toàn nguyên tố C ta có:
nCO2=nCaCO3=10100=0,1mol
→VCO2=0,1.22,4=2,24lít
Câu 9: Natri cacbonat là hóa chất quan trọng trong công nghiệp thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức của natri cacbonat là
A. Na2CO3.
B. NaHCO3.
C. MgCO3.
D. CaCO3.
Hướng dẫn giải:
Đáp án A
Công thức của natri cacbonat là Na2CO3.
Câu 10: Nung CaCO3 ở nhiệt độ cao, thu được chất khí X. Chất X là
A. CaO.
B. H2.
C. CO.
D. CO2.
Hướng dẫn giải:
Đáp án D
Khí X là CO2:
CaCO3 →to CaO (rắn) + CO2 (khí).
Câu 11. Không gặp Ba và các kim loại kiềm thổ khác trong tự nhiên ở dạng tự do vì:
A. Thành phần của chúng trong thiên nhiên rất nhỏ.
B. Kim loại kiềm thổ hoạt động hóa học mạnh.
C. Kim loại kiềm thổ dễ tan trong nước.
D. Kim loại kiềm thổ là những kim loại điều chế bằng cách điện phân.
Hướng dẫn giải
Đáp án: B
Các kim loại kiểm thổ hoạt động hóa học mạnh nên trong tự nhiên chúng thường tồn tại ở dạng hợp chất.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




