Phản ứng: Na2O + SO2 → Na2SO3
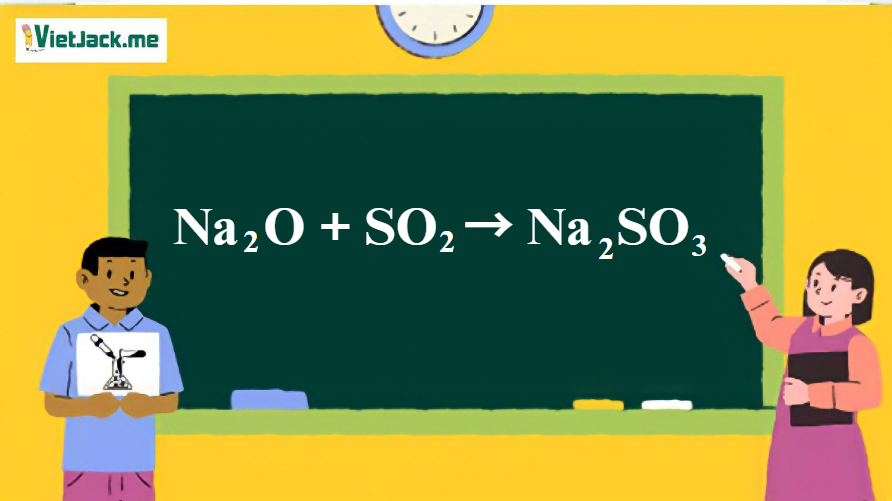
1. Phương trình phản ứng giữa Na2O và CO2
Na2O + SO2 –to→ Na2SO3
2. Điều kiện phản ứng
– Phản ứng xảy ra chậm ở đk thường, xảy ra nhanh khi nung nóng.
3. Cách thực hiện phản ứng
– Nung Na2O dưới nhiệt độ cao trong luồng khí SO2.
4. Hiện tượng nhận biết phản ứng
– Khối lượng sản phẩm thu được tăng lên so với ban đầu.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của Na2O
Natri oxit là một oxit bazơ nên nó có đầy đủ tính chất hóa học của một oxit bazơ tác dụng với nước, tác dụng với oxit axi, tác dụng với axit
5.2 Bản chất của SO2
– Trong phản ứng trên, SO2 là một oxit axit tác dụng với dung dịch bazo tạo thành muối và nước.
6. Tính chất hóa học của Na2O
Natri oxit là một oxit bazơ nên nó có đầy đủ tính chất hóa học của một oxit bazơ tác dụng với nước, tác dụng với oxit axi, tác dụng với axit
6.1. Natri oxit tác dụng với nước tạo thành dung dịch bazơ
Na2O tan trong nước để tạo thành dung dịch trong suốt, không màu, không mùi, không vị. Dung dịch này có tính ăn mòn như ăn mòn da, ăn mòn vải nên nó còn gọi khác là xút ăn da.
Na2O + H2O – > NaOH
6.2. Natri oxit tác dụng với oxit axit tạo ra muối
Ở trong môi trường bình thường sẵn sàng tác dụng với những oxit axit khác để tạo thành hỗn hợp mới là muối:
Với ví dụ phương trình như sau:
Na2O + CO2 -> Na2CO3
6.3. Natri oxit tác dụng với dung dịch axit tạo ra muối và giải phóng nước
Phương trình như sau:
Na2O + HCl -> NaCl + H2O
6.4. Tác dụng với oxi tạo ra peoxit, supeoxit
Natri oxit được tạo ra bởi phản ứng của natri với hidroxit, natri peroxit, hay natri nitrit
2NaO + 2Na -> 2Na2O + H2
Na2O2 + 2Na -> Na2O
2NaNO2 + 6Na -> 4Na2O + N2
Đối với natri trong không khí cũng tạo ra Na2O và khoảng 20% natri peroxit Na2O2
7. Ứng dụng của Na2O
– Được ứng dụng để làm thủy tinh, làm các ô kính, điển hình thủy tinh được sản xuất ra chứa 15% natri oxit, 70% silica và chứa 9% vôi CaO.
– Soda natri cacbonat hoạt động như một luôn để làm giảm nhịp độ Silica nóng chảy
– Thủy tinh soda có nhiệt độ nóng chảy thấp hơn nhiều so với thuỷ tinh thuần khiết và có được đàn hồi cao hơn. Những sự thay đổi trên xảy ra vì phản ứng với nhau tạo thành có công thức tổng quát là Na2[SiO2]x[SiO3].
Na2SO3 -> Na2O + CO2
Na2O + SiO2 -> Na2SiO3
– Những phẩm chất này phù hợp để sản xuất một loạt các sản phẩm thủy tinh bao gồm bóng đèn, kính, chai và các đối tượng nghệ thuật khác.
8. Tính chất hóa học của SO2
8.1 Lưu huỳnh đioxit tác dụng với nước:
SO2 + H2O ⇋ H2SO3
8.2 Lưu huỳnh đioxit tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
8.3 Lưu huỳnh đioxit tác dụng với oxit bazơ → muối:
SO2 + CaO → CaSO3
SO2 vừa là chất khử, vừa là chất oxi hóa (do S trong SO2 có mức oxi hóa trung gian +4)
8.4 Lưu huỳnh đioxit là chất oxi hóa:
SO2 + 2H2S → 3S + 2H2O
Lưu huỳnh đioxit là chất khử
9. Tính chất vật lí của SO2
Khí lưu huỳnh là chất khí không màu, nặng hơn không khí, mùi hắc, độc, tan nhiều trong nước. Có nhiệt độ nóng -72 độ C và nhiệt độ sôi -10 độ C. Ngoài ra, khí này có khả năng làm vẩn đục nước sôi, làm mất màu dung dịch brom và cánh hoa hồng.
10. Bạn có biết
– Na2O có thể phản ứng với các oxit axit khác tạo thành muối, tương tự như phản ứng với SO2.
11. Ví dụ minh họa
Ví dụ 1:
Thể tích SO2 ở dktc cần dung để phản ứng hoàn toàn với 0,1 mol Na2O tạo muối sunfit là
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
Hướng dẫn giải
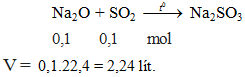
Đáp án B.
Ví dụ 2:
Chất nào sau đây không tác dụng với SO2?
A. Na2O. B. BaO. C. Li2O. D. CO2.
Hướng dẫn giải
CO2 không tác dụng với SO2.
Đáp án D.
Ví dụ 3:
Cho 2,24 lít khí SO2 ở đktc phản ứng hoàn toàn với Na2O tạo muối sunfit. Khối lượng muối thu được sau phản ứng là
A. 13,8 gam. B. 12,6 gam. C. 6,3 gam. D. 8,3 gam.
Hướng dẫn giải
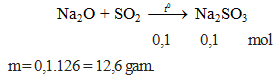
Đáp án B.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




