Phản ứng: Na2O + H2SO4 → Na2SO4 + H2O
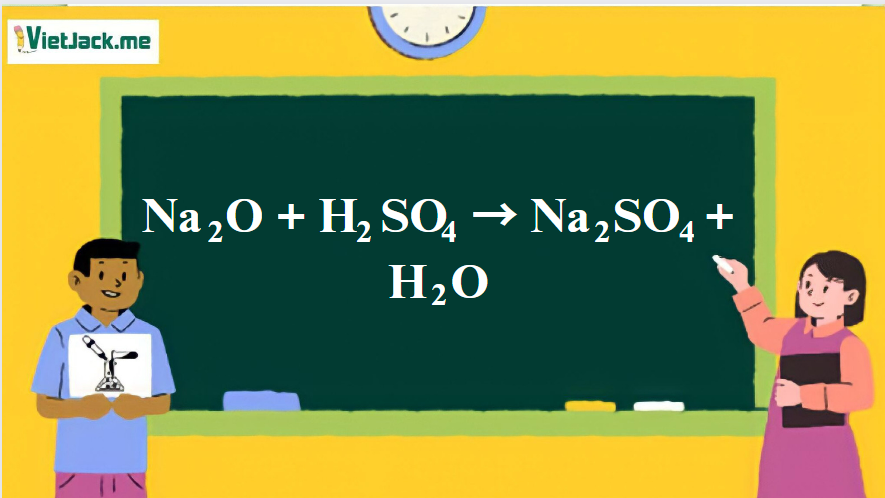
1. Phương trình phản ứng Na2O tác dụng H2SO4
Na2O + H2SO4 → Na2SO4 + H2O
2. Điều kiện phản ứng
– Phản ứng xảy ra ở điều kiện thường.
3. Cách thực hiện phản ứng
– Cho Na2O phản ứng với dung dịch axit H2SO4.
4. Hiện tượng nhận biết phản ứng
– Na2O tan dần, sau phản ứng thu được dung dịch không màu.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của Na2O
5.2 Bản chất của H2SO4
6. Tính chất hóa học của Na2O
Natri oxit là một oxit bazơ nên nó có đầy đủ tính chất hóa học của một oxit bazơ tác dụng với nước, tác dụng với oxit axi, tác dụng với axit
6.1. Natri oxit tác dụng với nước tạo thành dung dịch bazơ
Na2O tan trong nước để tạo thành dung dịch trong suốt, không màu, không mùi, không vị. Dung dịch này có tính ăn mòn như ăn mòn da, ăn mòn vải nên nó còn gọi khác là xút ăn da.
Na2O + H2O – > NaOH
6.2. Natri oxit tác dụng với oxit axit tạo ra muối
Ở trong môi trường bình thường sẵn sàng tác dụng với những oxit axit khác để tạo thành hỗn hợp mới là muối:
Với ví dụ phương trình như sau:
Na2O + CO2 -> Na2CO3
6.3. Natri oxit tác dụng với dung dịch axit tạo ra muối và giải phóng nước
Phương trình như sau:
Na2O + HCl -> NaCl + H2O
6.4. Tác dụng với oxi tạo ra peoxit, supeoxit
Natri oxit được tạo ra bởi phản ứng của natri với hidroxit, natri peroxit, hay natri nitrit
2NaO + 2Na -> 2Na2O + H2
Na2O2 + 2Na -> Na2O
2NaNO2 + 6Na -> 4Na2O + N2
Đối với natri trong không khí cũng tạo ra Na2O và khoảng 20% natri peroxit Na2O2
7. Tính chất vật lí của Na2O
Na2O tan trong nước để tạo thành dung dịch trong suốt, không màu, không mùi, không vị. Dung dịch này có tính ăn mòn như ăn mòn da, ăn mòn vải nên nó còn gọi khác là xút ăn da.
8. Tính chất hóa học của H2SO4
8.1 Tính chất hóa học của H2SO4 loãng
a. Làm đổi màu quỳ tím thành đỏ
b. Axit sunfuric loãng tác dụng với kim loại
Axit sunfuric loãng có khả năng tác dụng với kim loại đứng trước hidro trong dãy hoạt động hóa học của kim loại
Tác dụng với kim loại (Al, Fe, Zn, Mg,…) → muối sunfat + khí hidro
Ví dụ:
Fe + H2SO4 (loãng) → FeSO4 + H2
Mg + H2SO4 → MgSO4 + H2
c. Axit sunfuric loãng tác dụng với bazơ
Tác dụng với bazơ → muối sunfat + nước
Thí dụ:
H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
d. Axit sunfuric loãng tác dụng với oxit bazơ
Tác dụng với oxit bazơ → muối sunfat + nước
Ví dụ:
BaO + H2SO4 → BaSO4 + H2O
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + CuO → CuSO4 + H2O
e. Axit sunfuric loãng tác dụng với muối
Tác dụng với muối → muối (mới) + axit(mới)
BaCl2 + H2SO4 → BaSO4 + HCl
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
8.2 Tính chất hóa học của H2SO4 đặc
Trong H2SO4 thì S có mức oxi hóa +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.
Có những tính chất hóa học riêng
a. Axit sunfuric đặc tác dụng với kim loại trừ (Au, Pt)
Axit sunfuric tác dụng với kim loại tạo muối và nhiều sản phẩm oxi hóa khác nhau như SO2, H2S, S.
Ví dụ:
Cu + H2SO4 → CuSO4 + SO2 + H2O
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc, nguội
b. Tính háo nước của axit sunfuric đặc
C12H22O11 11H2O + 12C
c. Axit sunfuric đặc tác dụng với phi kim
C + 2H2SO4 đặc nóng → CO2 + 2SO2 + 2H2O
S + 2H2SO4 đặc nóng → 3SO2 + 2H2O
d. Axit sunfuric đặc tác dụng với các chất khử khác
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O
9. Bạn có biết
– Tương tự như với H2SO4, Na2O cũng phản ứng với các axit khác như HCl, HNO3 … thu được muối và nước.
10. Ví dụ minh họa
Ví dụ 1:
Cho m gam Na2O phản ứng vừa đủ với 100ml dung dịch H2SO4 1M. Giá trị của m là
A. 6,2. B. 4,7. C. 4,9. D. 7,4.
Hướng dẫn giải
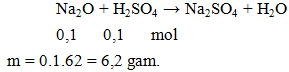
Đáp án A.
Ví dụ 2:
Chất nào sau đây không tác dụng với H2SO4?
A. NaOH. B. Na2O. C. Na. D. Na2SO4.
Hướng dẫn giải
Na2SO4 Nahông tác dụng với H2SO4.
Đáp án D.
Ví dụ 3:
Cho 3,1 gam Na2O tác dụng với một lượng vừa đủ dung dịch H2SO4, thu được dung dịch X. Khối lượng chất tan có trong dung dịch X là
A. 7,1 gam. B. 8.1 gam. C. 9,1 gam. D. 10.7 gam.
Hướng dẫn giải
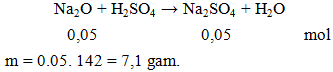
Đáp án A.
Na2O + H2SO4 → Na2SO4 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




