Phản ứng: KOH + CO2 → KHCO3
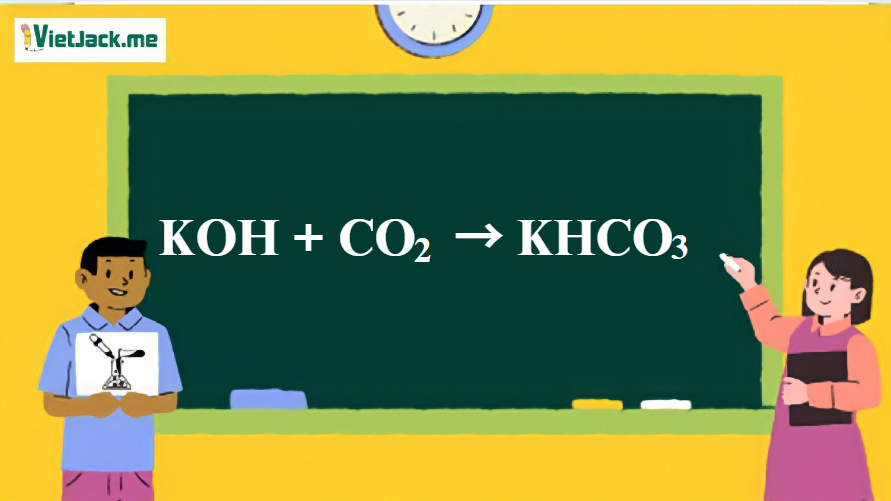
1. Phương trình phản ứng CO2 tác dụng với KOH
CO2 + KOH → KHCO3
2. Cách tiến hành phản ứng CO2 tác dụng với KOH
– Dẫn khí CO2 từ từ đến dư vào ống nghiệm chứa KOH và vài giọt chất chỉ thị.
3. Cách viết phương trình ion thu gọn của phản ứng CO2 tác dụng với KOH
Bước 1: Viết phương trình phân tử:
CO2 + KOH → KHCO3
Bước 2: Viết phương trình ion đầy đủ bằng cách: chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất điện li yếu, chất kết tủa, chất khí để nguyên dưới dạng phân tử:
CO2 + K+ + OH– → K+ + HCO3–
Bước 3: Viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách lược bỏ đi các ion giống nhau ở cả hai vế:
CO2 + OH– → HCO3–
4. Xác định sản phẩm của phản ứng CO2 tác dụng với KOH
– CO2 phản ứng với KOH chỉ thu được muối KHCO3 khi T = nKOHnCO2≤1.
– CO2 phản ứng với KOH chỉ thu được muối K2CO3 khi T = nKOHnCO2≥2.
– CO2 phản ứng với KOH thu được cả muối KHCO3 và K2CO3 khi 1< T = nKOHnCO2 < 2.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của CO2
Bản chất của CO2 trong phản ứng này là một chất khử yếu và là nguồn carbon cho quá trình hình thành muối bicarbonate.
5.2 Bản chất của KOH
KOH mang đầy đủ tính chất của một bazo mạnh
6. Tính chất hóa học của KOH
KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
Ở điều kiện nhiệt độ phòng, KOH tác dụng với oxit axit như SO2, CO2
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
6.1 KOH tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
6.2 KOH tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
6.3 KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới
KOH + Na → NaOH + K
6.4 KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
6.5 KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion Na+ và OH-
Phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
6.6 KOH hản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
7. Tính chất vật lí của KOH
– KOH là chất rắn màu trắng, không mùi, nhiệt độ sôi 1.327oC (1.6000 K; 2.421 oF), nhiệt độ nóng chảy 406 oC (679 K; 763 oF)
– Kali hiđroxit là một bazo mạnh, dễ dàng tác dụng với nước và cacbonic trong không khí để tạp thành Kali cacbonat.
– Ở dạng dung dịch, nó có khả năng ăn mòn thủy tinh, vải, giấy, da còn ở dạng chất rắn nóng chảy, nó ăn mòn được sứ, platin.
8. Tính chất hóa học của CO2
– Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
– CO2 là oxit axit, khi tan trong nước tạo thành axit cacbonic:
CO2 (k) + H2O (l) ⇄ H2CO3 (dd)
– Ngoài ra, CO2 còn tác dụng với oxit bazơ và dung dịch kiềm.
Thí dụ:
CaO + CO2 →to CaCO3
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
9. Bài tập vận dụng liên quan
Câu 1: Chất khí nào sau đây, được tạo ra từ bình chữa cháy và dùng để sản xuất thuốc giảm đau dạ dày?
A. CO2.
B. N2.
C. CO.
D. CH4.
Hướng dẫn giải:
Đáp án A
Chất khí được tạo ra từ bình chữa cháy là CO2.
Thuốc giảm đau dạ dày là NaHCO3.
NaOH + CO2 → NaHCO3.
Câu 2:Cho dãy các chất sau: CO2, CO, SiO2, NaHCO3, NH4Cl. Số chất trong dãy tác dụng với dung dịch NaOH loãng ở nhiệt độ thường là:
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải:
Đáp án B
Các chất thỏa mãn là CO2, NaHCO3 và NH4Cl.
CO2 + 2NaOH → Na2CO3 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
NH4Cl + NaOH → NH3↑ + NaCl + H2O
Chú ý: SiO2 chỉ phản ứng với dung NaOH đặc nóng hoặc NaOH nóng chảy.
Câu 3:Hình vẽ sau đây mô tả thí nghiệm điều chế và thu khí Y từ hỗn hợp rắn gồm CaCO3 và CaSO3:
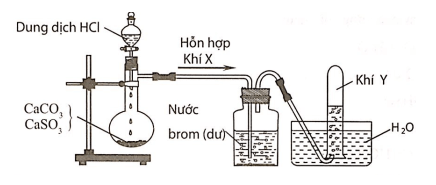
Khí Y là
A. CO2.
B. SO2.
C. H2.
D. Cl2.
Hướng dẫn giải:
Đáp án A
Hỗn hợp khí X gồm CO2 và SO2. Khí SO2 khi đi qua bình đựng nước brom đã bị giữ lại, còn khí Y thoát ra là CO2.
CaCO3→t0CaO+CO2
CaSO3→t0CaO+SO2
SO2+Br2+2H2O→2HBr+H2SO4
Câu 4:Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2, hiện tượng quan sát được là
A. có kết tủa, lượng kết tủa tăng dần, kết tủa không tan.
B. không có hiện tượng gì trong suốt quá trình thực hiện.
C. lúc đầu không thấy hiện tượng, sau đó có kết tủa xuất hiện.
D. có kết tủa, lượng kết tủa tăng dần, sau đó kết tủa tan.
Hướng dẫn giải:
Đáp án D
Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2 xảy ra phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Hiện tượng quan sát được: Dung dịch xuất hiện kết tủa trắng tăng dần đến cực đại, sau đó kết tủa tan dần đến hết.
Câu 5: “Nước đá khô” không nóng chảy mà dễ thăng hoa nên được dùng để tạo môi trường lạnh và khô, rất tiện cho việc bảo quản thực phẩm. “Nước đá khô” là
A. SO2 rắn.
B. CO2 rắn.
C. CO rắn.
D. H2O rắn.
Hướng dẫn giải:
Đáp án B
Nước đá khô là CO2 rắn.
Câu 6:Cho khí CO2 vào lượng dư dung dịch nào sau đây sẽ tạo kết tủa?
A.MgCl2.
B. Ca(OH)2.
C. Ca(HCO3)2.
D.NaOH.
Hướng dẫn giải:
Đáp ánB
A và C không phản ứng → loại.
D. CO2 + 2NaOHdư → Na2CO3 + H2O → loại.
B. CO2 + Ca(OH)2 dư → CaCO3↓ + H2O
Câu 7:Sục 1,12 lít CO2 (đktc) vào 200ml dung dịch Ba(OH)2 0,2M. Khối lượng kết tủa thu được là:
A. 5,91g.
B. 19,7g.
C. 78,8g.
D. 98,5g.
Hướng dẫn giải:
Đáp án A
nCO2=0,05mol;nBaOH2=0,04mol1<nCO2nBaOH2=1,25<2
→ Tạo hỗn hợp 2 muối.
→nCO32−=nOH−−nCO2=0,04.2−0,05=0,03mol
→n↓=0,03mol→m↓=0,03.197=5,91gam
Câu 8: Cho 5,6 lít CO2 (đktc) đi qua 164ml dung dịch NaOH 20% (d = 1,22g/ml) thu được dung dịch X. Cô cạn dung dịch X thì thu được khối lượng chất rắn là:
A. 15,5g.
B. 26,5g.
C. 31g.
D. 46,5g.
Hướng dẫn giải:
Đáp án D
nNaOH=164.1,22.20%40=1mol;nCO2=0,25mol→nNaOHnCO2=4
→ NaOH dư
→ Chất rắn gồm NaOH dư và muối Na2CO3.
Bảo toàn nguyên tố C:
nNa2CO3=nCO2=0,25mol
Bảo toàn nguyên tố Na:
nNaOH dư = 1 – 0,25.2 = 0,5 mol
→ mchất rắn = 0,25.106 + 0,5.40 = 46,5 gam
Câu 9: Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dung dịch Ca(OH)2 0,05M được kết tủa X và dung dịch Y. Khi đó khối lượng dung dịch Y so với khối lượng dung dịch Ca(OH)2 ban đầu sẽ là:
A. tăng 3,04g.
B. tăng 7,04g.
C. giảm 3,04g.
D. giảm 7,04g.
Hướng dẫn giải:
Đáp án A
nCO2=0,16mol;nCa(OH)2=0,1mol→1<nCO2nCa(OH)2=1,6<2
→ Dung dịch Y chỉ có muối Ca(HCO3)2 và kết tủa X là CaCO3
→n↓=nOH−−nCO2=0,1.2−0,16=0,04mol
→m↓=0,04.100=4gam
mCO2=0,16.44=7,04gam>m↓
→ Dung dịch sau phản ứng tăng 3,04 gam.
Câu 10: Hấp thụ hoàn toàn 1,568 lít CO2 (đktc) vào 500 ml dung dịch NaOH 0,16M thu được dung dịch X. Thêm 250 ml dung dịch Y gồm BaCl2 0,16M và Ba(OH)2 aM vào dung dịch X thu được 3,94g kết tủa và dung dịch Z. Giá trị của a là:
A. 0,015.
B. 0,02.
C. 0,03.
D. 0,04.
Hướng dẫn giải:
Đáp án B
nCO2=0,07mol;nNaOH=0,08mol;nBa(OH)2=0,25amolnBaCl2=0,04mol;nBaCO3↓=0,02mol
→∑nOH−=0,08+0,5a(mol)
Nhận thấy: n↓<nCO2<nBaCl2
→ Dung dịch Z chứa Na+:0,08molHCO3−Cl−:0,08molBa2+
Bảo toàn nguyên tố C:
nHCO3−=0,07−0,02=0,05mol
→∑nOH−=2nCO2+nHCO3−→0,08+0,5a=0,09→a=0,02mol
Câu 11: Hấp thụ toàn bộ 0,3 mol CO2 vào dung dịch chứa 0,25 mol Ca(OH)2. Khối lượng dung dịch sau phản ứng tăng hay giảm bao nhiêu gam?
A. tăng 13,2g.
B. tăng 20g.
C. giảm 6,8g.
D. giảm 16,8g.
Hướng dẫn giải:
Đáp án C
Ta có: 1<nCO2nCa(OH)2=1,2<2
→ Sau phản ứng thu được hai muối CaCO3 và Ca(HCO3)2
→nCaCO3=nOH−−nCO2=0,25.2−0,3=0,2mol
mCO2=0,3.44=13,2gamm↓=0,2.100=20gam>mCO2
→ Khối lượng dung dịch sau phản ứng giảm 6,8 gam.
Câu 12:Cho 3,36 lít khí CO2 (đktc) vào dung dịch chứa 500 ml KOH 0,1M và Ba(OH)2 0,12M kết thúc phản ứng thu được m gam kết tủa. Giá trị của m là
A. 2,55.
B. 3,94.
C. 1,97.
D. 4,925.
Hướng dẫn giải:
Đáp án B
nCO2=0,15mol;nBa2+=0,06mol;nOH−=0,17mol→nCO32−=nOH−−nCO2=0,02mol<nBa2+→n↓=0,02mol→m↓=0,02.197=3,94gam
Câu 13:Cho 10 gam CaCO3 vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được V lít CO2 (đktc). Giá trị của V là
A. 2,80.
B. 2,24.
C. 1,12.
D. 3,36.
Hướng dẫn giải:
Đáp án B
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bảo toàn nguyên tố C ta có:
nCO2=nCaCO3=10100=0,1mol
→VCO2=0,1.22,4=2,24lít
Câu 14: Cho 8,96 lít CO2 (đktc) sục vào dung dịch chứa 100 ml dung dịch chứa hỗn hợp Ca(OH)2 2M và NaOH 1,5M thu được a gam kết tủa và dung dịch X. Đun nóng kĩ dung dịch X thu được thêm b gam kết tủa. Giá trị (a + b) là
A. 5 gam
B. 15 gam
C. 20 gam
D. 40 gam
Hướng dẫn giải:
Đáp ánC
Theo bài → dung dịch X gồm các ion Na+,Ca2+,HCO3−
nCO32−+nHCO3−=nCO2=8,9622,4=0,4molnOH−=2nCO32−+nHCO3−=0,1.2.2+1,5=0,55mol
⇒nCO32−=0,15molnHCO3−=0,25mol→ dung dịch XNa+:0,15molHCO3−:0,25molCa2+
Bảo toàn điện tích →nCa2+=0,05mol
⇒a=100.0,15=15gb=100.0,05=5g⇒a+b=20
Câu 15: CO2 không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, CO2 không dùng để dập tắt đám cháy nào dưới đây?
A. đám cháy do xăng, dầu.
B. đám cháy nhà cửa, quần áo.
C. đám cháy do magie hoặc nhôm.
D. đám cháy do khí ga.
Hướng dẫn giải:
Đáp án C
Các kim loại mạnh như Mg, Al,..có thể cháy trong khí CO2
2Mg + CO2 →tO2MgO + C
4Al + 3CO2 →tO2Al2O3 + 3C
Do đó không dùng CO2 để dập tắt đám cháy do Mg, Al.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




