Phản ứng: Cu + H2SO4 (đặc,nóng) → CuSO4 + SO2 + H2O
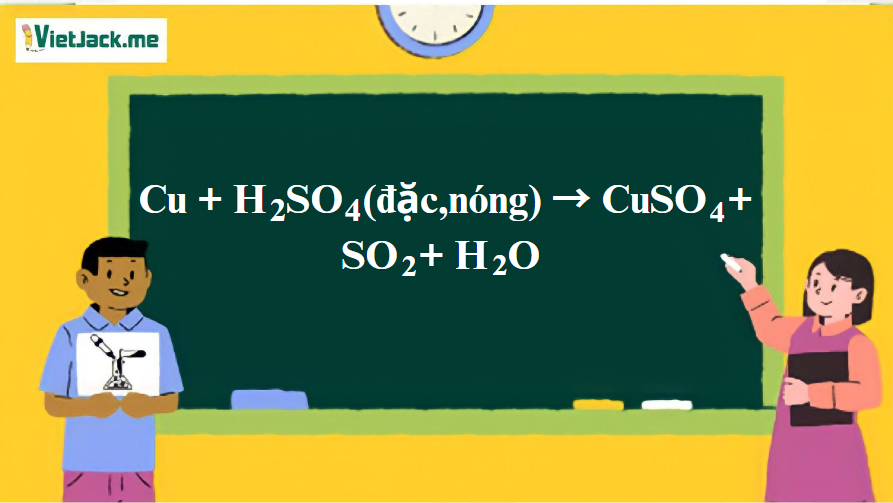
1. Phương trình phản ứng hóa học
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
2. Hiện tượng nhận biết phản ứng.
– Chất rắn màu đỏ Đồng (Cu) tan dần trong dung dịch và sủi bọt khí do khí mùi hắc Lưu huỳnh dioxit (SO2) sinh ra.
3. Điều kiện phản ứng
– Nhiệt độ
4. Bản chất của các chất tham gia phản ứng
4.1 Bản chất của Cu
Bản chất của Cu trong phản ứng là chất khử
4.2 Bản chất của H2SO4
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh
5. Tính chất hóa học của Cu
5.1 Tác dụng với phi kim:
Cu phản ứng với oxi khi đun nóng tạo CuO bảo vệ nên Cu không bị oxi hoá tiếp tục.
2Cu + O2 CuO
Khi tiếp tục đun nóng tới (800-1000oC)
CuO + Cu Cu2O (đỏ)
Tác dụng với Cl2, Br2, S…
Cu + Cl2 CuCl2
5.2 Tác dụng với axit:
- Cu không tác dụng với dung dịch HCl, H2SO4 loãng.
Khi có mặt oxi, Cu tác dụng với dung dịch HCl, nơi tiếp xúc giữa dung dịch axit với không khí.
2Cu + 4HCl + O2 → 2CuCl2 + 2 H2O
- Với HNO3, H2SO4 đặc :
Cu + 2H2SO4 đ → CuSO4 + SO2 + H2O
Cu + 4HNO3 đ → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
5.3 Tác dụng với dung dịch muối
Khử được ion kim loại đứng sau nó trong dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
6. Tính chất hóa học của H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
6.1 Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
6.2 Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
6.3 Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
7. Tính chất vật lí của H2SO4 đặc
– Tồn tại dưới dạng chất lỏng, không màu, không mùi và không vị.
– H2SO4 đặc nổi bật với khả năng hút nước rất mạnh và tỏa nhiều nhiệt. Vì vậy bạn chú ý không nên cho nước vào axit mà chỉ được phép cho axit vào nước. Để đánh trường hợp bị bỏng xảy ra khi nước tác dụng với axit. Và H2SO4 còn có thể pha loãng ra để trở thành H2SO4 lỏng.
8. Cách thực hiện phản ứng
– Cho vào ống nghiệm 1,2 lá đồng, nhỏ từ từ vừa đủ dung dịch H2SO4 đặc, sau đó đun nóng nhẹ ống nghiệm
9. Bạn có biết
– H2SO4 đặc, nóng tác dụng với đồng, sinh ra khí lưu huỳnh đioxit SO2 và dung dịch CuSO4 màu xanh lam.
10. Bài tập liên quan
Câu 1. Cho vào ống nghiệm 1,2 lá đồng, nhỏ từ từ vừa đủ dung dịch HNO3 đặc, sau đó đun nóng nhẹ ống nghiệm. Hiện tượng quan sát được khi cho Cu vào dung dịch HNO3 đặc là
A. Dung dịch chuyển sang màu vàng và có khí màu nâu đỏ thoát ra
B. Dung dịch chuyển sang màu nâu đỏ và có khí màu xanh thoát ra
C. Dung dịch chuyển sang màu xanh và có khí không màu thoát ra
D. Dung dịch chuyển sang màu xanh và có khí màu nâu đỏ thoát ra
Đáp án D
Cho vào ống nghiệm 1,2 lá đồng, nhỏ từ từ vừa đủ dung dịch HNO3 đặc, sau đó đun nóng nhẹ ống nghiệm. Hiện tượng quan sát được khi cho Cu vào dung dịch HNO3 đặc là dung dịch chuyển sang màu xanh và có khí màu nâu đỏ thoát ra
Phương trình ion thu gọn
3Cu + 8H+ + 2NO3– → 3Cu2+ + 2NO + 4H2O
Câu 2. Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sulfuric loãng đun nóng là vì
A. Phản ứng tạo ra kết tủa màu vàng và dung dịch có màu xanh lam.
B. Phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm.
C. Phản ứng tạo ra kết tủa màu xanh.
D. Dung dịch chuyển sang màu xanh và có khí không màu mùi sốc thoát ra
Đáp án D
Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sunfuric loãng đun nóng là vì phản ứng tạo dung dịch có màu xanh và khí không màu sốc thoát ra.
Phương trình phản ứng hóa học
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
Câu 3. Hiện tượng quan sát được khi cho Cu vào dung dịch H2SO4 đặc là
A. Dung dịch chuyển sang màu vàng và có khí màu nâu đỏ thoát ra
B. Dung dịch chuyển sang màu nâu đỏ và có khí màu xanh thoát ra
C. Dung dịch không chuyển màu và có khí không màu thoát ra
D. Dung dịch chuyển sang màu xanh và có khí không màu mùi sốc thoát ra
Đáp án D
Hiện tượng quan sát được khi cho Cu vào dung dịch H2SO4 đặc là
Dung dịch chuyển sang màu xanh và có khí không màu mùi sốc thoát ra
Phương trình phản ứng hóa học
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
Câu 4. Hòa tan hoàn tàn 6,4 gam Cu và trong dung dịch H2SO4 đặc thu được V lít sản phẩm khử duy nhất khí SO2 ở điều kiện tiêu chuẩn
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 8,96 lít
Đáp án A
nCu= 0,1 mol
Phương trình phản ứng hóa học
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
0,1 → 0,1 mol
nSO2 = 0,1 mol => VSO2 = 0,1.22,4 = 2,24 lít
Câu 5. Cho từ từ đến dư dung dịch NaOH vào dung dịch CuSO4, ta thấy:
A. Có kết tủa xanh, kết tủa không tan
B. Có kết tủa trắng và có khí bay ra
C. Tạo kết tủa trắng xanh sau chuyển thành kết tủa đỏ nâu.
D. Tạo kết tủa xanh sau đó kết tủa tan.
Đáp án A
Hiện tượng: Cho từ từ đến dư dung dịch NaOH vào dung dịch CuSO4, ta thấyc ó kết tủa xanh, kết tủa không tan
Phương trình phản ứng hóa học xảy ra
2NaOH + CuSO4→ Na2SO4 + Cu(OH)2
Câu 6. Cho 3,2 gam bột Cu tác dụng với 100 ml dung dịch gồm HNO3 0,8M và H2SO4 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
A. 1,792
B. 0,746
C. 0,672
D. 0,448
Đáp án C
Ta có nCu= 0,05 mol, nHNO3 = 0,08 mol, nH2SO4 = 0,02 mol,
nH+ = 0,12 mol ,, nNO3– = 0,08 mol
3Cu + 8H+ + 2NO3– → Cu2+ + 2NO + 4H2O
0,05 0,12 0,08 → 0,03
Ta có: 0,12/8 < 0,05/3 < 0,08/2 => H + phản ứng hết => nNO = 2/8.nH+ = 0,03 mol
=> V = 0,672 lít
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




