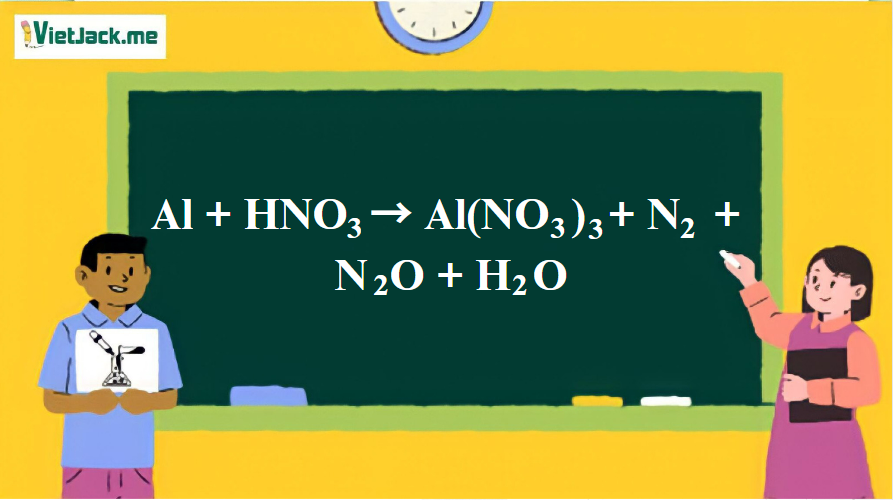
Phản ứng: Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O
1. Phương trình phản ứng
28Al + 102HNO3 → 28Al(NO3)3 + 6N2 + 3N2O + 51H2O
2. Điều kiện để phản ứng oxi hóa khử xảy ra
Nhiệt độ thường
3. Hướng dẫn cân bằng phản ứng oxi hóa khử
Xác định sự thay đổi số oxi hóa
Al0 + HN+5O3 → Al+3(NO3)3 + N02+ N+12O + H2O
|
Quá trình oxi hóa: 28x Quá trình khử: 3x |
Al0 → Al+3 + 3e N+5 +28e → N2+1 + 2N20 |
Đặt hệ số thích hợp ta được phương trình phản ứng:
28Al + 102HNO3 → 28Al(NO3)3 + 6N2 + 3N2O + 51H2O
4. Bản chất của các chất tham gia phản ứng
4.1 Bản chất của Al
– Al là kim loại có tính khử mạnh
4.2 Bản chất của HNO3
HNO3 là một axit mạnh. Trong phản ứng này, HNO3 cung cấp ion nitrat (NO3-) để tạo thành nh nitrat (Al(NO3)3).
5. Tính chất hóa học của Al
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
5.1. Tác dụng với phi kim
a) Tác dụng với oxi
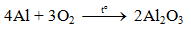
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
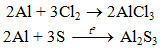
5.2 Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
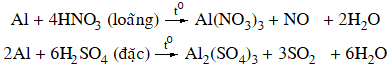
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
5.3 Tác dụng với oxit kim loại( Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
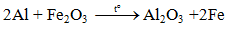
5.4 Tác dụng với nước
– Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
5.5 Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
5.6 Tác dụng với dung dịch muối
– Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
6. Tính chất hóa học của HNO3
6.1 Tính axit
Là một trong số các axit mạnh nhất, trong dung dịch:
HNO3 → H+ + NO3-
– Dung dịch axit HNO3 có đầy đủ tính chất của môt dung dịch axit: làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
6.2 Tính oxi hóa
Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa về trạng thái oxi hóa cao nhất.
– Với kim loại: HNO3 oxi hóa hầu hết các kim loại (trừ vàng (Au) và platin(Pt))
* Với những kim loại có tính khử yếu: Cu, Ag, …
Ví dụ:
Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
* Khi tác dụng với những kim loại có tính khử mạnh hơn: Mg, Zn, Al, …
– HNO3 đặc bị khử đến NO2.
Ví dụ:
Mg + 4HNO3(đ) → Mg(NO3)2 + 2NO2 + 2H2O.
– HNO3 loãng bị khử đến N2O hoặc N2.
8Al + 30HNO3(l) → 8Al(NO3)3 + 3N2O + 15H2O
– HNO3 rất loãng bị khử đến NH3(NH4NO3).
4Zn + 10HNO3 (rất loãng) → 4Zn(NO3)2 + NH4NO3 + 3H2O
* Lưu ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc nguội.
– Với phi kim:
Khi đun nóng HNO3 đặc có thể tác dụng với phi: C, P, S, …(trừ N2 và halogen).
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
– Với hợp chất:
– H2S, HI, SO2, FeO, muối sắt (II), … có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn.
Ví dụ:
3FeO + 10HNO3(đ) → 3Fe(NO3)3 + NO + 5H2O
3H2S + 2HNO3(đ) → 3S + 2NO + 4H2O
– Nhiều hợp chất hữu cơ như giấy, vải, dầu thông, … bốc cháy khi tiếp xúc với HNO3 đặc.
7. Tính chất vật lí của HNO3
Axit nitric là một chất lỏng không màu, dễ tan trong nước (C<65%). Nó cũng có thể tồn tại được ở dạng khí, không màu. Trong môi trường tự nhiên, axit nitric có màu vàng nhạt do sự tích tụ của oxit nitơ.
Axit nitric tinh khiết có tỷ trọng khoảng từ 1522 kg/m3, khi để bên ngoài không khí, nếu axit nitric có nồng độ 86% ta sẽ thấy khói trắng bốc lên.
Nhiệt độ đông đặc là -42°C và nhiệt độ sôi là 83°C.
Dưới tác dụng của ánh sáng mặt trời , axit nitric sẽ bị phân hủy tạo thành nitơ dioxit NO2 (nhiệt độ thường).
4HNO3 → 4NO2 + 2H2O + O2
Do đó ta cần nên bảo quản axit nitric trong các chai, lọ tối màu, tránh ánh sáng và nơi cất giữ phải đảm bảo nhiệt độ thấp hơn 0°C.
Ở nhiệt độ cao, nitơ dioxit sẽ bị hòa tan bởi axit nitric thành dung dịch có màu vàng hoặc đỏ. Điều này sẽ gây ảnh hưởng không hề nhỏ đến các tính vật lý, phụ thuộc vào nồng độ NO2 , đặc biệt chính là áp suất hơi trên chất lỏng, nhiệt độ sôi, màu sắc dung dịch.
Chưng cất dung dịch axit nitric và nước, ta được azeotrope có nồng độ 68% HNO3 và sẽ sôi ở nhiệt độ 120.5°C. Axit nitric là một loại axit có tính ăn mòn rất cao, cực độc, dễ dàng bắt lửa.
8. Câu hỏi bài tập liên quan
Câu 1. Cho phản ứng oxi hóa – khử: Al + HNO3 → Al(NO3)3 + N2O + N2 + H2O
Cho tỉ lệ mol nN2O: nN2 = 1 : 2. Hệ số cân bằng của HNO3 là
A. 102
B. 56
C. 124
D. 62
Câu 2. Cho phản ứng hóa học sau: Zn + HNO3 → Zn(NO3)2+ NO + NO2 + H2O
Tổng hệ số (nguyên, tối giản) của phản ứng trên là bao nhiêu? Biết tỉ lệ số mol NO : NO2 = 1 : 1)
A. 10
B. 12
C. 13
D. 15
Câu 3. Cặp chất nào dưới đây có thể tồn tại trong cùng một dung dịch?
A. K2SO4 và BaCl2
B. NaCl và AgNO3
C. HNO3và FeO
D. NaNO3 và AgCl
Câu 4. Kim loại nào sau đây không phản ứng được HNO3 đặc nguội
A. Al
B. Cu
C. Ag
D. Zn
Câu 5. Chất nào sau đây tác dụng với dung dịch NaAlO2 thu được kết tủa?
A. khí CO2.
B. dung dịch NaOH.
C. dung dịch Na2CO3.
D. dung dịch HCl dư.
Phương trình phản ứng minh họa
NaAlO2 + CO2 + 2H2O → Al(OH)3↓+ NaHCO3
NaAlO2 + HCl + H2O → NaCl + Al(OH)3↓
Al(OH)3 + 3HCl (dư) → AlCl3 + 3H2O
Câu 6. Nhận định không chính xác về nhôm là:
A. Nhôm là kim loại nhẹ, dễ dát mỏng.
B. Nhôm là kim loại có tính khử tương đối mạnh.
C. Trong công nghiệp, nhôm được điều chế bằng phương pháp điện phân nóng chảy.
D. Nhôm có thể khử được các oxit của kim loại kiềm.
Câu 7. Dãy các chất nào sau đây khi phản ứng với HNO3 đặc nóng đều tạo khí:
A. Cu(OH)2, FeO, C
B. Fe3O4, C, FeCl2
C. Na2O, FeO, Ba(OH)2
D. Fe3O4, C, Cu(OH)2
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




