Mời các bạn học sinh cùng tham khảo Đề thi Hóa học 12 Giữa kì 2 do trang Giải Bài Tập tổng hợp. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện để đạt điểm cao trong bài thi Hóa học 12.
Thời gian làm bài 45 phút
Nội Dung
ĐỀ BÀI
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133, Be = 9, Mg = 24, Ca = 40, Sr = 88, Ba = 137.
I. Phần trắc nghiệm
Câu 1: Trong các muối sau, muối nào dễ bị nhiệt phân?
A. NaCl.
B. Na2SO4.
C. Na2CO3.
D. NaHCO3.
Câu 2: Nhận định nào sau đây là sai?
A. Kim loại kiềm thuộc nhóm IA của bảng tuần hoàn.
B. Kim loại kiềm có màu trắng bạc và có ánh kim.
C. Từ Li đến Cs khả năng phản ứng với nước càng giảm.
D. Muốn điều chế kim loại kiềm từ các hợp chất, cần phải khử các ion của chúng.
Câu 3: Kim loại có tính khử mạnh nhất là
A. Na.
B. Li.
C. K.
D. Cs.
Câu 4: Thành phần chính của quặng đô – lô – mít là
A. CaCO3.MgCO3.
B. CaCO3.BaCO3.
C. CaCO3.CaSiO3.
D. BaCO3.MgCO3.
Câu 5: Cặp chất không xảy ra phản ứng là
A. dung dịch NaNO3 và dung dịch MgCl2.
B. dung dịch AgNO3 và dung dịch KCl.
C. Na2O và H2O.
D. dung dịch NaOH và Al2O3.
Câu 6: Điện phân nóng chảy muối clorua của một kim loại kiềm thu được 0,896 lít khí (đktc) ở anot và 3,12g kim loại ở catot. Công thức của muối là
A. KCl.
B. LiCl.
C. NaCl.
D. CsCl.
Câu 7: Để khử hoàn toàn 2,32 gam một oxit kim loại, cần dùng 0,896 lít khí H2 ở đktc. Kim loại đó là
A. Mg.
B. Cu.
C. Fe.
D. Cr.
Câu 8: Công dụng nào sau đây không phải của CaCO3
A. Làm vật liệu xây dựng.
B. Sản xuất xi măng.
C. Dùng làm thuốc chữa đau dạ dày.
D. Làm vôi quét tường.
Câu 9: Cho 10 gam một kim loại kiềm thổ tác dụng hết với nước thoát ra 5,6 lít khí (đktc). Kim loại kiềm thổ đó là
A. Ba.
B. Mg.
C. Ca.
D. Sr.
Câu 10: Nước cứng có tính vĩnh cửu có chứa các ion
A. Ca2+, Mg2+, HCO3–.
B. Ca2+, Mg2+, Cl–, NO3–.
C. Ca2+, Mg2+, Cl–, SO42-.
D. Ca2+, Mg2+, NO3–, SO42-.
II. Phần tự luận
Câu 1 (2 điểm): Viết các PTHH xảy ra trong sơ đồ sau:
CaCO3 → CaO → Ca(OH)2 → CaOCl2 → CaCl2.
Câu 2 (2 điểm): Hoà tan hoàn toàn 18,4 gam hỗn hợp hai muối cacbonat của hai kim loại X, Y thuộc hai chu kì liên tiếp trong nhóm II A bằng dung dịch HCl thu được 4,48 lít CO2 (đktc). Xác định tên hai kim loại X và Y.
Câu 3 (2 điểm): Sục 0,448 lít khí CO2 (đktc) vào 100ml dung dịch hỗn hợp Ba(OH)2 0,12M và KOH 0,06M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Tính giá trị của m.
Câu 4 (1 điểm): Hoà tan 13,68 gam muối MSO4 vào nước được dung dịch X. Điện phân X (với điện cực trơ, cường độ dòng điện không đổi) trong thời gian t giây, được y gam kim loại M duy nhất ở catot và 0,035 mol khí ở anot. Còn nếu thời gian điện phân là 2t giây thì tổng số mol khí thu được ở cả hai điện cực là 0,1245 mol. Tính giá trị của y.
ĐÁP ÁN CHI TIẾT
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | D | C | D | A | A | A | C | C | C | C |
Câu 1: 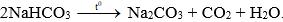
Câu 2: Nhận định sai: “Từ Li đến Cs khả năng phản ứng với nước càng giảm”. Chọn đáp án C.
Câu 3: Kim loại có tính khử mạnh nhất là Cs. Chọn đáp án D.
Câu 4: Thành phần chính của quặng đô – lô – mít là CaCO3.MgCO3. Chọn đáp án A.
Câu 5: Cặp chất không xảy ra phản ứng là dung dịch NaNO3 và dung dịch MgCl2. Chọn đáp án A.
Câu 6:
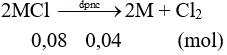
MM = 3,12 : 0,08 = 39. Vậy muối là KCl. Chọn đáp án A.
Câu 7: Loại đáp án A vì Mg không bị khử bởi H2.
Đặt oxit: AxOy.
Có nO = nH2 = 0,04 mol → mA (oxit) = 1,68 gam.
TH1: A là Cu → nCu (oxit) = 0,02625 → x : y = 0,02625 : 0,04 = 21 : 32 (loại)
TH2: A là Fe → nFe (oxit) = 0,03 → x : y = 3 : 4 → Fe3O4. Chọn đáp án C.
Không cần xét tiếp TH A là Cr.
Câu 8: Công dụng không phải của CaCO3 là dùng làm thuốc chữa đau dạ dày. Chọn đáp án C.
Câu 9: Bảo toàn e có nKL = nkhí = 0,25 mol → MKL = 10 : 0,25 = 40. Vậy KL là Ca. Chọn đáp án C.
Câu 10: Nước cứng có tính vĩnh cửu có chứa các ion Ca2+, Mg2+, Cl-2+, SO42-. Chọn đáp án C.
2. Phần tự luận
Câu 1 (2 điểm): HS viết đúng mỗi PTHH 0,5 điểm, sai điều kiện hoặc thiếu cân bằng trừ ½ số điểm mỗi PTHH.
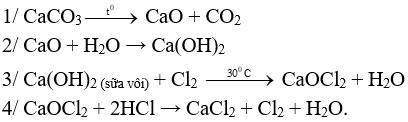
Câu 2 (2 điểm): Tính được số mol khí = 0,2 mol.
Đặt 2 muối tương ứng với một muối là RCO3.
Giả sử Mx < My → Mx < MR < My
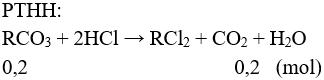
MRCO3 = 18,4 : 0,2 = 92 → MR = 32.
Vậy 2 kim loại là Mg và Ca.
Câu 3 (2 điểm): Tính được số mol CO2 = 0,02 và số mol OH– = 0,03 mol.
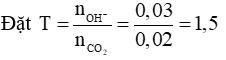

Giải hệ được: x = y = 0,01
Theo PT (3) → Ba2+ dư, m↓ = 0,01.197 = 1,97 gam.
Câu 4 (1 điểm):

MMSO4 = 13,68 : 0,0855 = 160 → M là Cu.
Tại t (s): nCu = 0,07 mol → mCu = 4,48 gam.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung học tập, giải trí và các kiến thức thú vị khác tại đây.