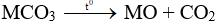
Mời các bạn học sinh cùng tham khảo Đề thi Hóa học 12 Giữa kì 2 do trang Giải Bài Tập tổng hợp. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện để đạt điểm cao trong bài thi Hóa học 12.
NỘI DUNG
ĐỀ BÀI
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133, Be = 9, Mg = 24, Ca = 40, Sr = 88, Ba = 137.
I. Phần trắc nghiệm
Câu 1: Phương pháp điều chế kim loại nhóm IIA là
A. phương pháp thủy luyện.
B. phương pháp điện phân dung dịch.
C. phương pháp điện phân nóng chảy.
D. tất cả các phương pháp trên.
Câu 2: Loại đá và khoáng chất nào sau đây không chứa canxi cacbonat?
A. Đá hoa cương.
B. Thạch cao.
C. Đá phấn.
D. Đá vôi.
Câu 3: Phát biểu nào sau đây là đúng?
(1) Na2CO3 được ứng dụng để sản xuất thủy tinh, bột giặt, …
(2) NaCl được dùng làm thuốc muối chữa bệnh dạ dày, bột nở.
(3) NaOH được ứng dụng trong chế biến dầu mỏ và sản xuất xà phòng, …
(4) CaSO4.2H2O được sử dụng làm vật liệu xây dựng, sản xuất: amoniac, clorua vôi, …
(5) Mg được ứng dụng sản xuất hợp kim nhẹ, chất tạo màu trắng trong pháo hoa, …
A. (1), (3), (5).
B. (1), (2), (3), (4).
C. (2), (3), (5).
D. (3), (4), (5).
Câu 4: Khi cho kim loại Na vào dung dịch CuSO4 thì sẽ xảy ra hiện tượng nào sau đây?
A. Ban đầu có xuất hiện kết tủa xanh, sau đó kết tủa tan ra, dung dịch trong suốt.
B. Ban đầu có sủi bọt khí, sau đó xuất hiện kết tủa xanh.
C. Ban đầu có sủi bọt khí, sau đó có tạo kết tủa xanh, rồi kết tủa tan ra, dd trong suốt.
D. Chỉ có sủi bọt khí.
Câu 5: Để loại hết Ca2+, Mg2+ ra khỏi dung dịch X gồm: Ca(HCO3)2; Mg(HCO3)2; Na2SO4 không thể dùng chất nào sau đây ở điều kiện thường?
A. Ca(OH)2 vừa đủ.
B. NaOH.
C. BaCl2
D. Na3PO4.
Câu 6: Cho một mẫu hợp kim Na – Ba tác dụng với nước (dư), thu được dung dịch X và 3,36 lít H2 (ở đktc). Thể tích dung dịch axit H2SO4 2M cần dùng để trung hoà dung dịch X là
A. 150ml.
B. 75ml.
C. 60ml.
D. 30ml.
Câu 7: Nhận định nào sau đây về nước cứng là sai ?
A. Nước cứng có chứa nhiều Ca2+; Mg2+.
B. Nước cứng có chứa 1 trong 2 ion Cl– và SO42- hoặc cả 2 là nước cứng tạm thời.
C. Nước không chứa hoặc chứa rất ít ion Ca2+ , Mg2+ là nước mềm.
D. Nước cứng có chứa đồng thời anion HCO3– và SO42- hoặc Cl– là nước cứng toàn phần.
Câu 8: Cho dd chứa 0,3 mol KOH tác dụng với 0,2 mol CO2. Dung dịch sau phản ứng gồm các chất nào sau đây?
A. KOH, K2CO3.
B. KHCO3.
C. K2CO3.
D. KHCO3, K2CO3.
Câu 9: Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị II, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch NaOH 1M, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 5,8 gam.
B. 6,5 gam.
C. 4,2 gam.
D. 6,3 gam.
Câu 10: Tính chất của kim loại kiềm và kiềm thổ là
A. dễ nhường eletron thể hiện tính oxi hoá.
B. dễ nhường electron thể hiện tính khử.
C. dễ nhận electron thể hiện tính oxi hoá.
D. dễ nhận electron thể hiện tính khử.
II. Phần tự luận
Câu 1 (2 điểm): Không dùng chất chỉ thị, hãy phân biệt các dung dịch sau chứa trong bình mất nhãn: CaCl2, NaCl, HCl.
Câu 2 (2 điểm): Cho 3,82 gam hỗn hợp G gồm 2 muối cacbonat của 2 kim loại kiềm (thuộc hai chu kì liên tiếp trong bảng tuần hoàn) vào dung dịch H2SO4 2M dư thu được 1,32 gam khí không màu bay ra. Tính % khối lượng của từng muối trong G.
Câu 3 (2 điểm): Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 125 ml dung dịch Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, tính nồng độ mol của chất tan trong dung dịch.
Câu 4 (1 điểm): Điện phân dung dịch CuCl2 với điện cực trơ, sau một thời gian thu được 0,32 gam Cu ở catôt và một lượng khí X ở anôt. Hấp thụ hoàn toàn lượng khí X trên vào 200 ml dung dịch NaOH (ở nhiệt độ thường). Sau phản ứng, nồng độ NaOH còn lại là 0,05M (giả thiết thể tích dung dịch không thay đổi). Tính nồng độ ban đầu của dung dịch NaOH.
ĐÁP ÁN CHI TẾT
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | C | B | A | B | C | B | B | D | D | B |
Câu 1: Phương pháp điều chế kim loại nhóm IIA là phương pháp điện phân nóng chảy. Chọn đáp án C.
Câu 2: Thạch cao không chứa canxi cacbonat. Chọn đáp án B.
Câu 3: Phát biểu đúng là:
(1) Na2CO3 được ứng dụng để sản xuất thủy tinh, bột giặt, …
(3) NaOH được ứng dụng trong chế biến dầu mỏ và sản xuất xà phòng, …
(5) Mg được ứng dụng sản xuất hợp kim nhẹ, chất tạo màu trắng trong pháo hoa, …
Chọn đáp án A.
Câu 4: Khi cho kim loại Na vào dung dịch CuSO4:
2Na + 2H2O → 2NaOH + H2 (↑)
CuSO4 + 2NaOH → Cu(OH)2 (↓ xanh) + Na2SO4. Chọn đáp án B.
Câu 5: Để loại hết Ca2+, Mg2+ ra khỏi dung dịch X gồm: Ca(HCO3)2; Mg(HCO3)2; Na2SO4 không thể dùng BaCl2 ở điều kiện thường. Chọn đáp án C.
Câu 6: nH+ = nOH– = 2nkhí = 0,3 mol → naxit = 0,15 mol → Vaxit = 0,15 : 2 = 75 ml.
Chọn đáp án B.
Câu 7: Nhận định sai là: Nước cứng có chứa 1 trong 2 ion Cl– và SO42- hoặc cả 2 là nước cứng tạm thời. Chọn đáp án B.
Câu 8:
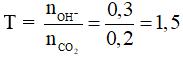
Câu 9:
Bảo toàn khối lượng: mCO2 = 13,4 – 6,8 = 6,6 gam → nCO2 = 0,15.
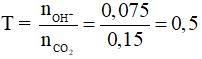
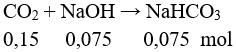
mmuối = 0,075.84 = 6,3 gam. Chọn đáp án D.
Câu 10: Tính chất của kim loại kiềm và kiềm thổ là dễ nhường electron thể hiện tính khử. Chọn đáp án B.
2. Phần tự luận
Câu 1 (2điểm): Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Nhỏ từ từ dd Na2CO3 vào từng mẫu thử.
Có khí bay lên → HCl
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
Xuất hiện kết tủa trắng → CaCl2
CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl
Không hiện tượng → NaCl
Câu 2 (2điểm): Giả sử 2 kim loại là A và B, giả sử MA < MB.
Đặt 2 kim loại tương ứng với 1 KL là R → MA < MR < MB
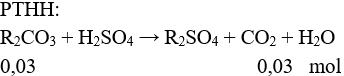
→ MR2CO3 = 3,82 : 0,03 = 127,33 → MR = 33,67.
Vậy 2 muối là Na2CO3 (x mol) và K2CO3 (y mol)
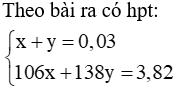
Giải hệ được x = 0,01 và y = 0,02
→ %mNa2CO3 = 27,75%; %mK2CO3 =72,25%.
Câu 3 (2điểm):
Tính được số mol CO2 = 0,15 mol, số mol OH– = 0,25 mol

Câu 4 (1điểm): Tính được nCu = 0,005 mol, nNaOH dư = 0,05.0,2 = 0,01 mol
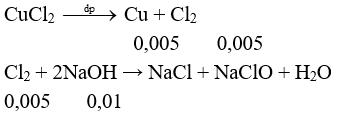
nNaOH bđ = 0,01 + 0,01 = 0,02 mol → CM bđ = 0,02 : 0,2 = 0,1M.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung học tập, giải trí và các kiến thức thú vị khác tại đây.