Phản ứng Al + H2SO4 → Al2(SO4)3 + SO2 + H2O
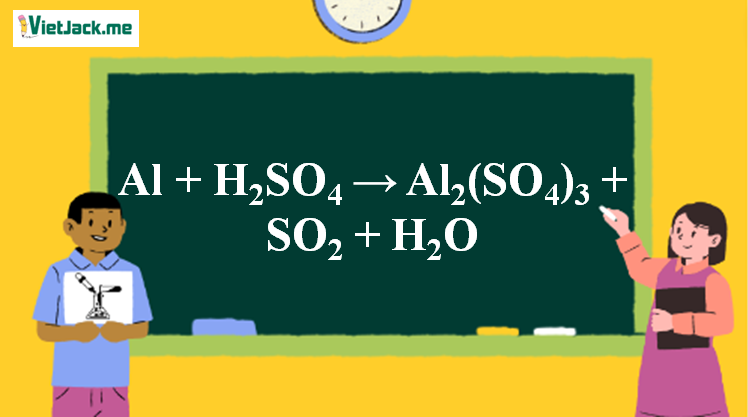
1. Phương trình phản ứng nhôm tác dụng với H2SO4 đặc nóng
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
2. Điều kiện phản ứng nhôm tác dụng với H2SO4 đặc nóng
Nhiệt độ thường
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Al (Nhôm)
– Trong phản ứng trên Al là chất khử.
– Al tác dụng với các axit có tính oxi hoá mạnh như dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng. (Chú ý: Al bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội)
3.2. Bản chất của H2SO4 đặc nóng (Axit sunfuric)
– Trong phản ứng trên H2SO4 là chất oxi hoá.
– Trong H2SO4 thì S có mức oxi hoá +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hoá mạnh và háo nước.
4. Cách tiến hành phản ứng Zn và dung dịch H2SO4 đặc
Bỏ mẩu nhôm vào ống nghiệm, sau đó nhỏ vài giọt dung dịch H2SO4 đặc nóng vào trong ống nghiệm đựng sẵn mẩu kẽm.
5. Hiện tượng sau phản ứng
Mẩu nhôm tan dần, xuất hiện khí không màu, có mùi hắc chính là lưu huỳnh đioxit (SO2).
6. Tính chất hóa học của Nhôm
6.1. Tác dụng với oxi và một số phi kim
4Al + 3O2→ 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
6.2. Nhôm tác dụng với axit (HCl, H2SO4 loãng,..).
– Tác dụng với axit (HCl, H2SO4 loãng,..)
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3 đặc, nguội
– Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
6.3. Tác dụng với dung dịch muối của kim loại yếu hơn
AI + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
6.4. Tính chất hóa học riêng của nhôm
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
6.5. Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3+ 2Al → 2Fe + Al2O3
6.6. Ứng dụng
Máy cắt rất dễ kiếm và các bộ phận trong nhà máy sản xuất được làm bằng Al. Với đặc tính sáng và không rỉ sét, Al dần trở thành vật liệu không thể thiếu đối với mọi nhà máy. Một số mặt hàng được làm bằng Al, chẳng hạn như: Khung xe máy, khung xe hơi, thùng xe tải, các chi tiết tản nhiệt…
Đặc biệt, Al được sử dụng trong sản xuất trong ngành hàng không vũ trụ. Thân máy bay và cánh được làm bằng nhôm. Các ứng dụng dựa vào trọng lượng riêng nhẹ và bền của nhôm là rất cần thiết để tiết kiệm tối đa trọng lượng trong không khí.
7. Tính chất hoá học của H2SO4
7.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
7.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
8. Bài tập vận dụng liên quan
Câu 1. Nhận định nào sau đây sai về tính chất vật lí của nhôm?
A. Nhôm là kim loại nhẹ, dẫn nhiệt tốt.
B. Nhôm là kim loại màu trắng bạc, có ánh kim.
C. Nhôm dẫn điện tốt hơn đồng.
D. Nhôm có tính dẻo dễ kéo sợi.
Lời giải:
A đúng vì nhôm là kim loại nhẹ, dẫn nhiệt tốt.
B đúng vì nhôm là kim loại màu trắng bạc, có ánh kim.
C sai vì nhôm có độ dẫn điện bằng 23 độ dẫn điện đồng (dẫn điện kém hơn đồng).
D đúng nhôm có tính dẻo dễ kéo sợi.
Câu 2. Khi điện phân Al2O3 nóng chảy người ta thêm criolit (Na3AlF6) với mục đích:
(1) Làm hạ nhiệt độ nóng chảy của Al2O3.
(2) Làm cho tính dẫn điện cao hơn.
(3) Để thu được F2 ở anot thay vì là O2.
(4) Tạo hỗn hợp nhẹ hơn Al để bảo vệ Al.
Các lý do nêu đúng là:
A. Chỉ có 1
B. 1 và 2
C. 1 và 3
D. 1, 2 và 4
Lời giải:
Khi điện phân Al2O3 nóng chảy người ta thêm criolit (Na3AlF6) với mục đích:
1. Làm hạ nhiệt độ nóng chảy của Al2O3.
2. Làm cho tính dẫn điện cao hơn.
4. Tạo hỗn hợp nhẹ hơn Al để bảo vệ Al.
Câu 3. Trong vỏ Trái Đất có nhiều quặng nhôm hơn sắt nhưng giá mỗi tấn nhôm cao hơn nhiều so với giá mỗi tấn sắt. Lí do vì:
A. Chuyển vận quặng nhôm đến nhà máy xử lí tốn kém hơn vận chuyển quặng sắt
B. Nhôm hoạt động mạnh hơn sắt nên để thu hồi nhôm từ quặng sẽ tốn kém hơn
C. Nhôm có nhiều công dụng hơn sắt nên nhà sản xuất có thể có lợi nhuận nhiều hơn
D. Quặng nhôm ở sâu trong lòng đất trong khi quặng sắt từng thấy ngay trên mặt đất
Lời giải:
Nguyên liệu để sản xuất nhôm là quặng bôxit có thành phần chủ yếu là Al2O3. Sử dụng phương pháp điện phân hỗn hợp nóng chảy của nhôm oxit và criolit nên tốn kém hơn khi điều chế sắt
Câu 4. Dãy nào sau đây sắp xếp các kim loại đúng theo thứ tự tính khử tăng dần?
A. Pb, Ni, Sn, K
B. Pb, Sn, Ni, K
C. Ni, Sn, K, Pb
D. Ni, K, Pb, Sn
Lời giải:
Dãy được sắp xếp các kim loại đúng theo thứ tự tính khử tăng dần là: Pb, Sn, Ni, K
Câu 5. Dãy kim loại nào dưới đây tác dụng được H2SO4 đặc nguội?
A. Zn, Cu, Fe
B. Ni, Fe, Cu
C. Cu, Zn, Mg
D. Cu, Fe, Mg
Lời giải:
Phương trình hóa học minh họa
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
2Fe + 6H2SO4 → Fe2(SO4)3+ 3SO2↑ + 6H2O
4Mg + 5H2SO4 → 4MgSO4 + H2S + 4H2O
Câu 6. Cho dung dịch chứa FeCl2 và ZnCl2 tác dụng với dung dịch KOH dư, sau đó lấy kết tủa nung trong không khí đến khối lượng không đổi thu được chất rắn gồm:
A. Fe2O3
B. FeO
C. FeO, ZnO
D. Fe2O3, ZnO
Lời giải:
Phương trình phản ứng minh họa
FeCl2 + 2NaOH → Fe(OH)2 + 2KCl
ZnCl2+ 4KOH dư → K2ZnO2 + 2KCl + 2H2O
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Fe(OH)3 → Fe2O3 + H2O
Vậy chất rắn là Fe2O3
Câu 7. Cho a gam nhôm tác dụng với dung dịch H2SO4 (đặc, nóng, dư) sau khi phản ứng kết thúc người ta thu 13,44 lit khí SO2 (đktc). Giá trị a là
A. 2,7 gam
B. 10,8 gam
C. 8,1 gam
D. 5,4 gam
Lời giải:
nSO2 = 13,4422,4 = 0,6 mol
Phương trình hóa học
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
0,4 ← 0,6 mol
mAl = 0,4.27 = 10,8 gam
Câu 8. Một thanh kim loại A hóa trị II được nhúng vào trong 1 lít dung dịch CuSO4 0,5M. Sau khi lấy thanh A ra và cân lại thấy khối lượng thanh tăng 1,6 gam, nồng độ CuSO4 còn 0,3M. Hãy xác định kim loại A?
A. Fe
B. Mg
C. Zn
D. Pb
Lời giải:
A + Cu2+ → A2+ + Cu
Số mol Cu2+ phản ứng là: 1(0,5 – 0,3) = 0,2 mol
Độ tăng khối lượng của thanh kim loaị A:
mA = mCu– mA tan = 0,2(64 – A) = 1,6
Suy ra: A = 56 là Fe
Câu 9. Có thể dùng hóa chất nào sau đây để phân biệt 3 chất rắn Mg, Al, Al2O3 đựng trong các lọ riêng biệt?
A. H2SO4 loãng.
B. NaOH.
C. HCl đặc.
D. Amoniac.
Lời giải:
Sử dụng thuốc thử NaOH
Cho từng chất rắn trong lọ tác dung với NaOH.
Mẫu thử không có hiện tượng xảy ra chất ban đầu là Mg.
Mẫu thử có chất rắn tan dần, có khí thoát ra → Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Mẫu thử có chất rắn tan dần → Al2O3
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Câu 10. Dùng m gam Al để khử hết 3,2 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 1,344 lít khí (đktc). Giá trị của m là
A. 0,540 gam.
B. 0,810gam.
C. 1,080 gam.
D. 2,160 gam.
Lời giải:
Sản phẩm sau phản ứng tác dụng với dung dịch NaOH có khí thoát ra → Al dư
Phương trình phản ứng
2Al + Fe2O3→ 2Fe + Al2O3
0,04 0,02 mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,04 0,06 mol
→ nAl = 0,04 + 0,04 = 0,08 mol → mAl = 0,08.27 = 2,16 gam.
Câu 11. Cho 2,7 gam bột nhôm tác dụng với 50 ml dung dịch NaOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn thu được V lít khí hiđro (đktc). Giá trị của V là
A. 4,48 lít.
B. 0,672 lít.
C. 0,448 lít.
D. 0,336 lít.
Lời giải:
Phương trình hóa học
2Al + 2NaOH+ 2H2O → 2NaAlO2+ 3H2
0,1 0,1 mol
Sau phản ứng Al dư, NaOH hết
nkhí = 0,015 mol → V = 0,015.22,4 = 0,336 lít.
Câu 12. Mô tả nào dưới đây không phù hợp với nhôm?
A. Trong hợp chất, số oxi hóa của Al là +3.
B. Cấu hình electron [Ne]3s23p1.
C. Tinh thể cấu tạo lập phương tâm diện.
D. Ở ô thứ 13, chu kì 2, nhóm IIIA.
Lời giải:
Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử
Nhôm (Al) ở ô số 13, thuộc nhóm IIIA, chu kì 3 của bảng tuần hoàn.
Cấu hình electron nguyên tử: 1s22s22p63s23p1; viết gọn là [Ne]3s23p1.
Nhôm dễ nhường cả 3 electron hóa trị nên có số oxi hóa +3 trong các hợp chất.
Câu 13. Trong vỏ Trái Đất có nhiều quặng nhôm hơn sắt nhưng giá mỗi tấn nhôm cao hơn nhiều so với giá mỗi tấn sắt. Lí do vì:
A. Chuyển vận quặng nhôm đến nhà máy xử lí tốn kém hơn vận chuyển quặng sắt
B. Nhôm hoạt động mạnh hơn sắt nên để thu hồi nhôm từ quặng sẽ tốn kém hơn
C. Nhôm có nhiều công dụng hơn sắt nên nhà sản xuất có thể có lợi nhuận nhiều hơn
D. Quặng nhôm ở sâu trong lòng đất trong khi quặng sắt từng thấy ngay trên mặt đất
Lời giải:
Nguyên liệu để sản xuất nhôm là quặng bôxit có thành phần chủ yếu là Al2O3. Sử dụng phương pháp điện phân hỗn hợp nóng chảy của nhôm oxit và criolit nên tốn kém hơn khi điều chế sắt
Câu 14. Có 3 lọ không nhãn, mỗi lọ đựng một trong các chất rắn sau: Cu, Mg, Al. Thuốc thử để nhận biết 3 chất trên là
A. Lần lượt NaOH và HCl.
B. Lần lượt là HCl và H2SO4 loãng.
C. Lần lượt NaOH và H2SO4 đặc nóng.
D. Tất A, B, C đều đúng.
Lời giải:
Dể nhận biết 3 chất rắn trên thì ta dùng lần lượt dung dịch NaOH và HCl.
Cho dung dịch NaOH vào 3 ống nghiệm đựng chất rắn, chất rắn nào tan và sủi bọt khí là Al, 2 ống không hiện tượng là Cu và Mg
Phương trình hóa học: 2Al + 2NaOH + 2H2O → 2NaAlO2+ 3H2 ↑
Cho dung dịch HCl vào 2 chất rắn còn lại, chất rắn nào tan và sủi bọt khí là Mg, chất rắn không hiện tượng là Cu
Phương trình hóa học: Mg + 2HCl → MgCl2 + H2↑
Câu 15. Hiện tượng quan sát được khi ta đổ từ từ dung dịch NaOH đến dư vào dung dịch AlCl3 là:
A. Xuất hiện kết tủa keo trắng đến cực đại, sau đó kết tủa không tan khi cho dư NaOH
B. Xuất hiện kết tủa keo trắng đến cực đại, sau đó kết tủa tan từ từ đến khi cho dư NaOH, dung dịch thu được trong suôt
C. Không có hiện tượng gì xảy ra
D. Ban đầu không có hiện tượng gì, sau đó xuất hiện kết tủa keo trắng từ từ đến cực đại.
Lời giải:
Hiện tượng quan sát được khi ta đổ từ từ dung dịch NaOH đến dư vào dung dịch AlCl3 là:
Xuất hiện kết tủa keo trắng đến cực đại, sau đó kết tủa tan từ từ đến khi cho dư NaOH, dung dịch thu được trong suôt
Phương trình hóa học: 3NaOH + AlCl3 → 3NaCl + Al(OH)3
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Dung dịch NaAlO2 là dung dịch trong suốt
Câu 16. Nhôm tác dụng được với dung dịch axit HCl, H2SO4 loãng vì:
A. Nhôm là kim loại.
B. Nhôm có tính dẻo nên dễ tác dụng với axit.
C. Nhôm có lớp oxit mỏng.
D. Nhôm là kim loại đứng trước H trong dãy hoạt động hóa học.
Lời giải:
Nhôm tác dụng với dung dịch axit HCl, H2SO4 loãng vì nhôm là kim loại đứng trước H trong dãy hoạt động hóa học.
Câu 17. Cho các lọ hóa chất mất nhãn được đựng trong các lọ riêng biệt sau: NaCl, MgCl2, FeCl2, FeCl3, AlCl3, NH4Cl, (NH4)2SO4. Chỉ được sử dụng 1 loại thuốc thử duy nhất để nhận biết các lọ hóa chất mất nhãn trên, hóa chất đó là:
A. KOH
B. Ba(OH)2
C. Ca(NO3)2
D. AgNO3
Lời giải:
Trích mẫu thử và đánh số thứ tự
Dùng Ba(OH)2 dư cho từ từ vào các dung dịch mẫn nhãn trên
Ống nghiệm nào không có hiện tượng gì thì chất ban đầu là KCl
Ống nghiệm nào xuất hiện kết tủa trắng thì chất ban đầu là MgCl2
MgCl2 + Ba(OH)2→ Mg(OH)2↓ + BaCl2
Ống nghiệm nào xuất hiện kết tủa trắng xanh, sau đó một thời gian chuyển sang nâu đỏ thì chất ban đầu là FeCl2
FeCl2 + Ba(OH)2 → Fe(OH)2↓ + BaCl2
4Fe(OH)2 ↓trắng xanh + O2 + 2H2O → 4Fe(OH)3↓ nâu đỏ
Ống nghiệm nào xuất hiện màu nâu đỏ, thì chất ban đầu là FeCl3
2FeCl3+ 3Ba(OH)2 → 2Fe(OH)3↓ + 3BaCl2
AlCl3: Ban đầu xuất hiện kết tủa trắng keo, sau đó kết tủa tan dần đến hết
AlCl3+ Ba(OH)2 → Al(OH)3↓ + BaCl2
2Al(OH)3 + Ba(OH)2→ Ba(AlO2)2 + 4H2O
NH4Cl: xuất hiện khí trong dung dịch
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + H2O
(NH4)2SO4: đồng thời xuất hiện bọt khí và kết tủa trắng
(NH4)2SO4+ Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
Xem thêm các phương trình hóa học khác:
Al + H2SO4 → Al2(SO4)3 + S + H2O
Al + HNO3 → H2O + NO2 + Al(NO3)3
Al + HNO3 → Al(NO3)3 + N2O + H2O
Al + HNO3 → Al(NO3)3 + N2 + H2O
Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




