Phản ứng Al + HNO3 → Al(NO3)3 + N2↑ + H2O
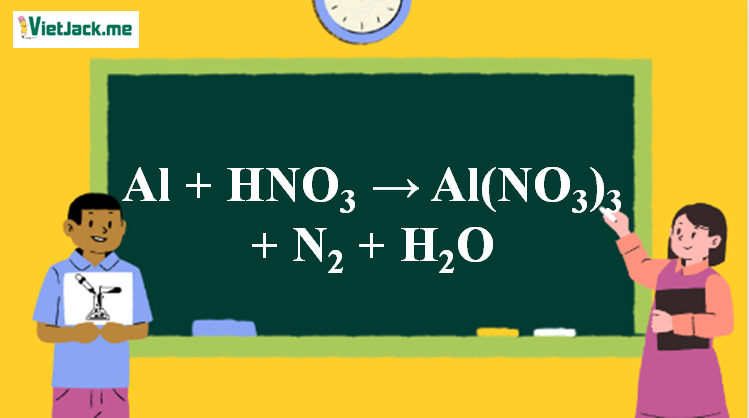
1. Phương trình phản ứng Al tác dụng HNO3
10Al + 36HNO3 loãng → 10Al(NO3)3 + 3N2↑ + 18H2O
2. Cách cân bằng phản ứng Al tác dụng HNO3
a) Xác định vai trò của từng chất tham gia phản ứng và nêu sự oxi hóa, sự khử:
Al0 + H+5NO3 loãng →Al+3(NO3)3+ N02+ H2O
Số oxi hóa của Al tăng từ 0 lên +3 => Al là chất khử
Số oxi hóa của N giảm từ +5 xuống 0 => HNO3 là chất oxi hóa
Sự oxi hóa: Al → Al+3 + 3e
Sự khử: 2N+5 + 10e → N2
b) Cân bằng phản ứng trên theo phương pháp thăng bằng electron.
0Al + H+5NO3 loãng →+3Al(NO3)3+ 0N2 + H2O
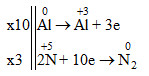
3. Điều kiện phản ứng xảy ra Al tác dụng HNO3
Dung dịch HNO3 loãng
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Al (Nhôm)
– Trong phản ứng trên Al là chất khử.
– Al tác dụng với các axit có tính oxi hoá mạnh như dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng. (Chú ý: Al bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội)
4.2. Bản chất của HNO3 (Axit nitric)
– Trong phản ứng trên HNO3 là chất oxi hoá.
– Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
5. Tính chất hóa học của nhôm
5.1. Tác dụng với oxi và một số phi kim
4Al + 3O2→ 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
5.2. Nhôm tác dụng với axit (HCl, H2SO4 loãng,..)
- Tác dụng với axit (HCl, H2SO4 loãng,..)
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3 đặc, nguội
- Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
5.3. Tác dụng với dung dịch muối của kim loại yếu hơn
AI + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
5.4. Tính chất hóa học riêng của nhôm
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
5.5. Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3+ 2Al → 2Fe + Al2O3
Một số phản ứng khác như:
3CuO+ 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
5.6. Ứng dụng
Máy cắt rất dễ kiếm và các bộ phận trong nhà máy sản xuất được làm bằng Al. Với đặc tính sáng và không rỉ sét, Al dần trở thành vật liệu không thể thiếu đối với mọi nhà máy. Một số mặt hàng được làm bằng Al, chẳng hạn như: Khung xe máy, khung xe hơi, thùng xe tải, các chi tiết tản nhiệt…
Đặc biệt, Al được sử dụng trong sản xuất trong ngành hàng không vũ trụ. Thân máy bay và cánh được làm bằng nhôm. Các ứng dụng dựa vào trọng lượng riêng nhẹ và bền của nhôm là rất cần thiết để tiết kiệm tối đa trọng lượng trong không khí.
6. Tính chất hóa học của HNO3
– Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
– Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
– Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
– Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
– Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
– Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
– Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
– Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
– Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
– Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
7. Bài tập vận dụng liên quan
Câu 1. Phát biểu nào sau đây là sai?
A. Dung dịch AlCl3 và Al2(SO3)3 làm quỳ tím hóa hồng
B. Al(OH)3, Al2O3, Al đều là các chất lưỡng, tính
C. Nhôm là kim loai nhẹ và có khả năng dẫn điện Iot
D. Từ Al2O3 có thế điều chế được Al.
Lời giải:
Sai: Al(OH)3, Al2O3, Al đều là các chất lưỡng, tính
Al không phải chất lưỡng tính
Câu 2. Hiện tượng nào xảy ra khi cho từ từ đến dư dung dịch NaOH vào dung dịch AlCl3?
A. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện
B. Xuất hiện kết tủa keo trắng ngay lập tức, sau đó kết tủa tan dần
C. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện, rồi tan dần.
D. Xuất hiện kết tủa keo trắng ngay lập tức và không tan,
Lời giải:
Phương trình phản ứng
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
NaOH + Al(OH)3→ NaAlO2 + 2H2O
Xuất hiện kết tủa keo trắng ngay lập tức, sau đó kết tủa tan dần
Câu 3. Cho 3,82 gam hợp kim Ba, Al vào nước dư chỉ thu được dung dịch chưa duy nhất một muối. Khối lượng Ba là:
A. 3.425 gam.
B. 1,644 gam.
C. 1,370 gam,
D. 2,740 gam
Lời giải:
Câu 4. Cho một lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy có một lớp thủy ngân bám trên bề mặt nhôm. Hiện tượng tiếp theo quan sát được là:
A. khí hiđro thoát ra mạnh.
B. khí hiđro thoát ra sau đó dừng lại ngay.
C. lá nhôm bốc cháy.
D. lá nhôm tan ngay trong thủy ngân và không có phản ứng.
Lời giải:
2Al + 3Hg(NO3)2 → 2Al(NO3)3 + 3Hg
Al sẽ tạo với Hg hỗn hống. Hỗn hống Al tác dụng với nước
2Al + 6H2O → 2Al(OH)3+ 3H2
Câu 5. Cho sơ đồ phản ứng sau: Al → X → Al2O3 → Y→ Z → Al(OH)3
X, Y, Z lần lượt có thể là:
A. Al(NO3)3, NaAlO2, AlCl3
B. Al(NO3)3, Al(OH)3, AlCl3
C. AlCl3, Al2(SO4)3, NaAlO2
D. AlCl3, NaAlO2, Al2(SO4)3
Lời giải:
Al → X (Al(NO3)3) → Al2O3 → Y(NaAlO2) → Z(AlCl3) → Al(OH)3
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
2Al(NO3)3→ Al2O3 + 6NO2 + 32O2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
NaAlO2 + 4HCl → NaCl + AlCl3 + 2H2O
AlCl3 + 3NH3 + 3H2O → Al(OH)3+ 3NH4Cl
Câu 6. Nhỏ từ từ cho đến dư dung dịch KOH vào dung dịch AlCl3 hiện tượng xảy ra là
A. Có kết tủa keo trắng, sau đó kết tủa tan.
B. Chỉ có kết tủa keo trắng.
C. Có kết tủa keo trắng và khí bay lên.
D. Không có kết tủa, có khí bay lên.
Lời giải:
Nhỏ từ từ cho đến dư dung dịch KOH vào dung dịch AlCl3, ban đầu có kết tủa keo trắng xuất hiện.
3KOH + AlCl3 → Al(OH)3 ↓ + 3NaCl
Sau đó kết tủa keo trắng tan trong NaOH dư tạo dung dịch trong suốt (vì Al(OH)3 có tính lưỡng tính tan được trong dung dịch axit dư, và kiêm dư)
KOH + Al(OH)3 → KAlO2 + 2H2O
Câu 7. Cặp chất nào sau đây có thể tồn tại được trong cùng một dung dịch
A. AlCl3 và Na2CO3
B. KNO3 và NaOH
C. AgNO3 và KCl
D. BaCl2 và H2SO4
Lời giải:
Phương trình phản ứng
A. Al2(SO4)3 + 3Na2CO3 → Al2(CO3)3 + 3Na2SO4
C. KCl + AgNO3 → AgCl + KNO3
D. H2SO4+ BaCl2 → BaSO4 + 2HCl
Câu 8. Chất nào sau đây lưỡng tính?
A. Fe(OH)3.
B. Mg(OH)2.
C. NaCl.
D. Al(OH)3.
Lời giải:
Câu 9. Cho 300 ml dung dịch NaOH 2M vào 200ml dung dịch Al2(SO4)3 0,4M, lắc đều cho đến khi phản ứng kết thúc ta thu được kết tủa Z. Tính khối lượng kết tủa thu được.
A. 1,56 gam.
B. 3,12 gam.
C. 6,24 gam.
D. 2,34 gam.
Lời giải:
Ta có theo đầu bài
nNaOH= 0,15.2 = 0,6 mol;
nAl2(SO4)3 = 0,1.0,4 = 0,08 mol.
Phương trình hóa học:
6NaOH + Al2(SO4)3 → 3Na2SO4 + 2Al(OH)3 ↓
Theo đề bài 0,6 0,08
Phản ứng: 0,48 ← 0,08 → 0,16 mol
Sau phản ứng: 0,12 0,16 mol
NaOH + Al(OH)3 → NaAlO2 + 2H2O
0,12 → 0,12 mol
⟹ n↓= 0,16 – 0,12 = 0,04 mol
⟹ m↓ = 0,04.78 = 3,12 gam.
Câu 10. Cho 1 lít dung dịch NaOH tác dụng với 600 ml dung dịch Al2(SO4)3 0,2M thu được 3,12 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Nồng độ mol/lít của dung dịch NaOH.
A. 0,12M
B. 0,12M hoặc 0,92M
C. 0,92M
D. 0,15M hoặc 0,92M
Lời giải:
Theo bài ra, ta có: nAl2(SO4)3 = 0,6.0,2 = 0,12 (mol) ⇒ nAl3+ = 2.0,12 = 0,24 (mol).
Cũng theo bài ra, nAl(OH)3 = 3,1278 = 0,04 (mol).
Ta thấy n↓ < nAl3+ và bài không yêu cầu tính lượng NaOH là min hay max nên có 2 trường hợp xảy ra:
TH1: Chỉ tạo kết tủa và Al3+ còn dư, khi đó chỉ xảy ra phản ứng tạo kết tủa.
Al3+ + 3OH– → Al(OH)3
0,12 0,04
=> [NaOH] = nV= 0,121 = 0,12M.
TH2: Kết tủa sinh ra và bị hòa tan một phần.
n↓còn lại = 4nAl3+ – nOH– → nOH– = 4nAl3+ – n↓ = 4.0,24 – 0,04 = 0,92 mol.
=> [NaOH] = nV= 0,921 = 0,92 M.
Câu 11. Trong các cặp chất sau đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và K2CO3
B. HNO3 và KHCO3
C. KAlO2 và NaOH
D. NaCl và AgNO3
Lời giải:
Câu 12. Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3 ?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch Ca(OH)2
Lời giải:
Khi cho NH3 vào 2 dung dịch cả 2 dung dịch đều xuất hiện kết tủa hiđroxit, nhưng Zn(OH)2 tạo thành có khả năng tạo phức với NH3 nên kết tủa lại tan, còn với Al(OH)3 không tan trong
Câu 13. Cho 1 gam kim loại R vào 200 ml dung dịch AgNO3 0,25M đến khi phản ứng hoàn toàn thu được dung dịch không chứa ion Ag+ và có khối lượng giảm so với khối lượng của dung dịch AgNO3 ban đầu là 4,4 gam. Kim loại R là?
A. Cu.
B. Ca.
C. Zn.
D. Fe.
Lời giải:
*Trường hợp 1: R (hóa trị n) phản ứng trực tiếp với AgNO3
Phương trình phản ứng:
R + nAgNO3→ R(NO3)n + nAg
0,05n → 0,05 → 0,05 mol
mdd giảm= mAg– mR pứ= 0,05.108 – 0,05Rn= 4,4
→ Rn= 20 → Loại
*Trường hợp 2: R là Ca
Ca + H2O → Ca(OH)2+ H2
0,025 → 0,025 → 0,025 mol
Ca(OH)2 + 2AgNO3→ Ca(NO3)2+ 2AgOH ↓
0,025 → 0,05 → 0,05
2AgOH → Ag2O + H2O
0,05 → 0,025 mol
ndd giảm= mAg2O+ mH2 – mCa = 0,025.232 + 0,025.2 – 1= 4,85 gam: Loại
*Vậy R là Fe.
2.nFe < nAgNO3 < 3.nFe → Fe tan hết, Ag+ chuyển hết thành Ag
mdd giảm= mAg– mFe = 0,05.108 – 1= 4,4 gam
Câu 14. Nhúng một đinh sắt vào 200ml dung dịch CuSO4 1M. Sau một thời gian lấy đinh sắt ra, sấy khô và đem cân thì thấy khối lượng đinh sắt tăng lên 0,4g. Xem như thể tích dung dịch thay đổi không đáng kể. Vậy nồng độ của CuSO4 còn lại sau phản ứng là:
A. 0,75M
B. 0,5M
C. 0,65M
D. 0,8M
Lời giải:
Số mol CuSO4 ban đầu là 0,2 mol
Gọi x là số mol Fe phản ứng:
Fe + CuSO4 → FeSO4 + Cu
x → x → x
56x (g) 64x (g)
Khối lượng định sắt tăng lên là: 64x – 56x = 8x
Ta có: 8x = 0,4 → x = 0,05 mol
Số mol CuSO4 dư = 0,2 – 0,05 = 0,15 mol
CMCuSO4= 0,150,2 = 0,75M
Câu 15. Phản ứng nhiệt nhôm (đun nóng oxit kim loại với Al ở nhiệt độ cao) dùng điều chế những kim loại nào?
A. Al, Fe, Mg
B. Fe, Cr, Cu
C. Cu, Na, Zn
D. Ca, Fe, Cu
Lời giải:
Al khử được những oxit kim loại yếu hơn nó
Loại A vì Mg mạnh hơn Al
Loại C vì Na mạnh hơn Al
Loại D vì Ca mạnh hơn Al
Xem thêm các phương trình hóa học khác:
Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Al + HNO3 → Al(NO3)3 + NO + H2O
Al2O3 + NaOH → NaAlO2 + H2O
Al2O3 + HCl → AlCl3 + H2O
Al2O3 + H2SO4 → Al2(SO4)3 +H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




