Phản ứng Ba(OH)2 + (NH4)2SO4 → H2O + NH3↑ + BaSO4↓
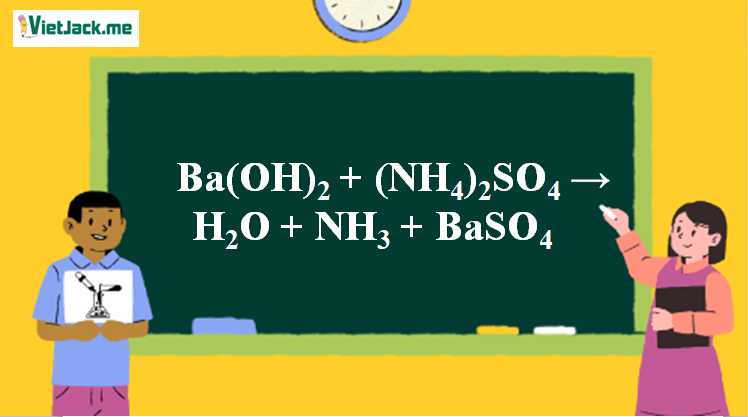
1. Phương trình phản ứng
Ba(OH)2 + (NH4)2SO4 → H2O + 2NH3↑ + BaSO4↓
2. Phương trình ion của phản ứng Ba(OH)2 + (NH4)2SO4
(NH4)2SO4 và Ba(OH)2 là các chất dễ tan và phân li mạnh
(NH4)2SO4→ 2NH4+ + SO42-
Ba(OH)2 → Ba2+ + 2OH–
2NH4+ + SO42- + Ba2+ + 2OH– → BaSO4↓ + NH3 + H2O
Lược bỏ các ion giống nhau ở vế trái và vế phải.
2NH4+ + SO42- + Ba2+ + 2OH– → BaSO4↓ + NH3↑ + H2O
(Phương trình này không có ion nào bị loại bỏ)
3. Điều kiện phản ứng
Nhiệt độ thường
4. Cách thực hiện phản ứng
Cho dung dịch Ba(OH)2 tác dụng với (NH4)2SO4
5. Hiện tượng nhận biết phản ứng
Khi cho bari hiđroxit phản ứng với amoni sunfat xuất hiện kết tủa trắng BaSO4 và khí amoniac.
6. Bản chất của các chất tham gia phản ứng
6.1. Bản chất của Ba(OH)2 (Bari hidroxit)
Ba(OH)2 là một bazo mạnh tác dụng được với muối (NH4)2SO4.
6.2. Bản chất của (NH4)2SO4 (Amoni sunfat)
(NH4)2SO4 là một hợp chất muối của gốc amoni tác dụng với các bazo như NaOH, KOH, Ba(OH)2, … tạo khí NH3.
7. Tính chất hoá học của muối amoni
7.1.Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
7.2. Tác dụng với dung dịch kiềm
(nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
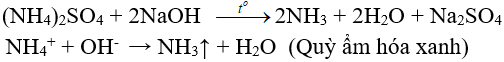
7.3. Phản ứng nhiệt phân
– Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
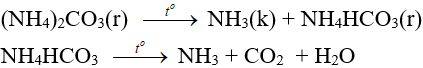
NH4HCO3 (bột nở) được dùng làm xốp bánh.
– Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
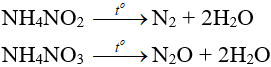
– Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
8. Tính chất hóa học của Ba(OH)2
Mang đầy đủ tính chất hóa học của một bazơ mạnh.
Phản ứng với các axit:
Ba(OH)2 + 2HCl → BaCl2+ 2H2O
Phản ứng với oxit axit: SO2, CO2…
Ba(OH)2 + SO2 → BaSO3 + H2O
Ba(OH)2 + 2SO2 → Ba(HSO3)2
Phản ứng với các axit hữu cơ tạo thành muối:
2CH3COOH + Ba(OH)2 → (CH3COO)2Ba + 2H2O
Phản ứng thủy phân este:
2CH3COOC2H5 + Ba(OH)2 → (CH3COO)2Ba + 2 C2H5OH
Phản ứng với muối:
Ba(OH)2 + CuCl2 → BaCl2 + Cu(OH)2↓
Tác dụng một số kim loại mà oxit, hidroxit của chúng có tính lưỡng tính (Al, Zn…):
Ba(OH)2 + 2Al + 2H2O → Ba(AlO2)2 + 3H2↑
Tác dụng với hợp chất lưỡng tính:
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2
9. Điều chế Ba(OH)2
Bari hidroxit có thể được điều chế bằng cách hòa tan bari oxit (BaO) trong nước:
BaO + H2O → Ba(OH)2
10. Bài tập vận dụng liên quan
Câu 1. Chất phản ứng được với dung dịch H2SO4 tạo ra kết tủa là:
A. BaCl2 B. Na2CO3 C. NaOH D. NaCl
Lời giải:
Đáp án: A
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Câu 2. Cho các cặp chất: (a) Na2CO3 và BaCl2; (b) NaCl và Ba(NO3)2; (c) NaOH và H2SO4. Số cặp chất xảy ra phản ứng trong dung dịch thu được kết tủa là:
A. 0 B. 3 C. 2 D. 1
Lời giải:
Đáp án: D
(a) Na2CO3 + BaCl2 → NaCl + BaCO3↓
(b) Không phản ứng
(c) NaOH + H2SO4 → Na2SO4 + H2O
Câu 3. Viết phương trình phân tử và ion rút gọn của các phản ứng sau (nếu có)
a) H2SO4 + BaCl2 →
b) BaCl2 + Na2CO3 →
c) Ba(HCO3)2 + K2CO3 →
d) NaOH dư + H3PO4 →
e) FeSO4 + KMnO4+ H2SO4→
Lời giải:
a) H2SO4 + BaCl2 → BaSO4 + 2HCl
SO42- + Ba2+ → BaSO4↓
b) BaCl2 + Na2CO3 → BaCO3+ 2NaCl
Ba2+ + CO32- → BaCO3
c) Ba(HCO3)2+ K2CO3 → BaCO3 + 2KHCO3
Ba2+ + CO32- → BaCO3
d) 3NaOH + H3PO4 → Na3PO4 + 3H2O
3OH– + H3PO4 → PO43- + 3H2O
e) 10FeSO4+ 8H2SO4 + 2KMnO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Câu 4. Trộn dung dịch chứa Ba2+; OH− 0,03 mol và Na+ 0,01 mol với dung dịch HCO3− 0,02 mol; CO32− 0,015 mol và Na+. Tính khối lượng kết tủa thu được sau khi trộn là bao nhiêu?
Lời giải:
Áp dụng định luật bảo toàn điện tích ta có:
2nBa2+ + nNa+= nOH−
=>2.nBa2+ + 1.0,01 = 1.0,06 = >nBa2+ = 0,01 (mol)
HCO3− + OH− → CO32− + H2O
=> nCO32−= 0,035 mol
nCO32− > nBa2+
nBaCO3= nBa2+ = 0,01 mol
=> mBaCO3↓ = 0,01.197 = 1,97 (g)
Câu 5. Một dung dịch X chứa 0,01 mol Ba2+, 0,01 mol NO3-, a mol OH-, b mol Na+. Để trung hòa lượng dung dịch X này cần dùng 400 ml dung dịch HCl có pH = 1. Khối lượng chất rắn thu được sau khi cô cạn dung dịch X là:
A. 3,36 gam
B. 1,68 gam
C. 2,56 gam
D. 3,42 gam
Lời giải:
a = nOH− =nH+=0,1.0,4 = 0,04 mol
Bảo toàn điện tích
2nBa2+ + nNa+ = nNO3− + nOH− ⇒ 2.0,01 + b = 0,01 + 0,04
=> b = 0,03
mchất rắn = 0,01.137 + 0,01.62 + 0,04.17 + 0,03.23 = 3,36 gam
Câu 6. Dung dịch X chứa m gam 3 ion : Mg2+, NH4+, SO42-. Chia dung dịch X thành 2 phần bằng nhau. Phần 1 cho tác dụng với dung dịch KOH thu được 5,8 gam kết tủa. Phần 2 đun nóng với
A. 77,4
B. 43,8
C. 21,9
D. 38,7
Lời giải:
nMg(OH)2= 0,1 mol; nNH3 = 0,15 mol
Mg2+ + 2OH– → Mg(OH)2
NH4+ + OH– → NH3 + H2O
Trong mỗi phần có : 0,1 mol Mg2+ và 0,15 mol NH4+
Bảo toàn điện tích:
nSO42−(1phan) =1/2.(2nMg + nNH4+) = 0,175 mol
=> m = (0,1.24 + 0,15.18 + 0,175.96).2 = 43,8 gam
Xem thêm các phương trình hóa học khác:
NH4NO3 + Ba(OH)2 → Ba(NO3)2 + NH3 + H2O
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
(NH4)2SO4 + BaCl2 → NH4Cl + BaSO4
(NH4)2SO4 + NaOH → Na2SO4 + NH3 + H2O
Pb(OH)2 + NaOH → Na2PbO2 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




