Cấu hình electron của Ne, neon chương trình mới
1. Cấu hình electron nguyên tử neon (Z = 10)
– Neon có số hiệu nguyên tử là 10 ⇒ nguyên tử Ne có 10 electron.
– Cấu hình electron nguyên tử neon là 1s22s22p6.
Viết gọn: [He]2s22p6.
2. Cấu hình electron nguyên tử neon (Z = 10) theo ô orbital.
– Cấu hình electron nguyên tử neon (Z = 10) theo ô orbital là:
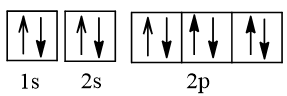
– Nguyên tử Ne không có electron độc thân, lớp ngoài cùng đã bão hòa (8 electron lớp ngoài cùng).
3. Mối quan hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
– Vị trí Ne trong bảng tuần hoàn:
Từ cấu hình electron của Ne là 1s22s22p6 xác định được:
+ Ne thuộc ô thứ 10 (do Z = 10)
+ Chu kì 2 (do có 2 lớp electron)
+ Nhóm VIIIA (do có 8 electron hóa trị, nguyên tố p).
+ Là nguyên tố p (do có cấu hình electron lớp ngoài cùng là 2s22p6).
– Tính chất nguyên tố:
+ Ne thuộc nhóm VIIIA, lớp ngoài cùng có 8 electron đã bão hòa nên Ne là khí hiếm.
+ Ne trơ về mặt hóa học.
4. Ví dụ
Câu 1. Nguyên tử M có số hiệu nguyên tử Z = 10. Trong bảng tuần hoàn, nguyên tố M thuộc chu kì
A. 4
B. 3
C. 2
D. 1
Lời giải:
Đáp án đúng là: C
Nguyên tử M có Z = 10 = số electron.
⇒ Cấu hình electron nguyên tử của M là 1s22s22p6
M có 2 lớp electron ⇒ Thuộc chu kì 2.
Câu 2: Cấu hình electron của X– giống với cấu hình electron của nguyên tử Y. Biết nguyên tử X có tổng số electron ở phân lớp p là 5. Xác định vị trí của Y trong bảng tuần hoàn hóa học?
A. Chu kì 3, nhóm IIIA.
B. Chu kì 2, nhóm IIIA.
C. Chu kì 3, nhóm VIIIA.
D. Chu kì 2, nhóm VIIIA.
Lời giải:
Đáp án đúng là: D
Nguyên tử X có tổng số electron ở phân lớp p là 5.
⇒ Cấu hình electron của nguyên tử X là 1s22s22p5
⇒ Cấu hình electron của Y và ion X– là 1s22s22p6.
⇒ Y có 2 lớp electron và 8 electron lớp ngoài cùng.
⇒ Y thuộc chu kì 2, nhóm VIIIA.
Xem thêm cách viết cấu hình electron của các nguyên tố hóa học hay, chi tiết khác:
Cấu hình electron của H, hydrogen (hiđro) chương trình mới
Cấu hình electron của He, helium (heli) chương trình mới
Cấu hình electron của Li, lithium (liti) chương trình mới
Cấu hình electron của Be, beryllium (beri) chương trình mới
Cấu hình electron của B, boron (bo) chương trình mới
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.


