Phản ứng CuO + HNO3 → Cu(NO3)2 + H2O
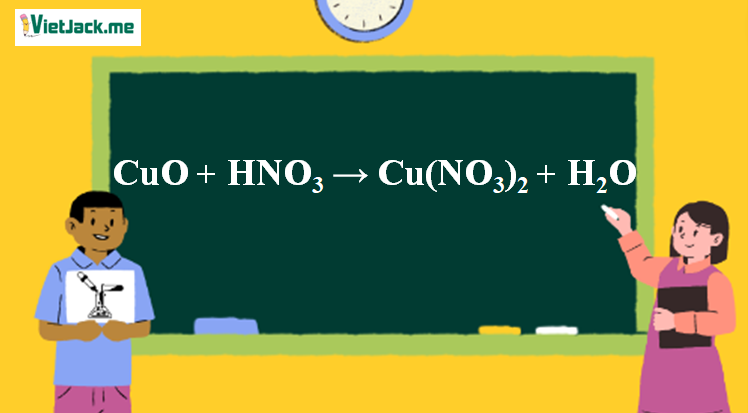
1. Phương trình phản ứng CuO tác dụng HNO3 loãng
CuO + 2HNO3→ Cu(NO3)2 + H2
2. Điều kiện phản ứng CuO tác dụng với HNO3
Không có
3. Cách tiến hành phản ứng cho CuO tác dụng HNO3
Cho đồng oxit CuO tác dụng với dung dịch axit nitric HNO3.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của CuO (Đồng oxit)
CuO là một oxit bazo tác dụng được với axit.
4.2. Bản chất của HNO3 (Axit nitric)
HNO3 là một axit mạnh tác dụng với oxit bazo tạo muối và nước.
5. Hiện tượng Hóa học
Chất rắn màu đen Đồng II Oxit (CuO) tan dần trong dung dịch axit, sản phẩm thu được dung dịch có màu xanh làm của muối đồng nitrat.
6. Mở rộng kiến thức về CuO
6.1. Tính chất vật lí và nhận biết
– Tính chất vật lí: Là chất rắn, có màu đen, không tan trong nước, nóng chảy ở 1148độC.
– Nhận biết: Dẫn khí H2 dư qua bột oxit đồng có màu đen, đun nóng, sau một thời gian thấy xuất hiện chất rắn màu đỏ (Cu).
H2 + CuO 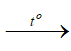 H2O + Cu
H2O + Cu
6.2. Tính chất hóa học
– Có đầy đủ tính chất hóa học của một oxit bazơ.
– Dễ bị khử về kim loại đồng.
a. Tác dụng với axít
CuO + 2HCl → CuCl2 + H2O
CuO + 2HNO3 → Cu(NO3)2 + H2O
b. Tác dụng với oxit axit
3CuO + P2O5 → Cu3(PO4)2
c. Tác dụng với các chất khử mạnh: H2, C, CO…
H2 + CuO 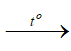 H2O + Cu
H2O + Cu
CO + CuO 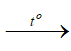 CO2 + Cu
CO2 + Cu
6.3. Điều chế
Đốt cháy kim loại đồng trong oxi:
Cu + O2 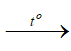 CuO
CuO
6.4. Ứng dụng
– Trong thủy tinh,gốm
– Đồng(II) oxit được dùng trong vật liệu gốm để làm chất tạo màu sắc. Trong môi trường ôxy hoá bình thường, CuO không bị khử thành Cu2O và nó tạo màu xanh lá trong cho men.
– Oxit đồng là một flux khá mạnh. Nó làm tăng độ chảy loãng của men nung và tăng khả năng crazing do hệ số giãn nở nhiệt cao.
– CuO trong men bari/thiếc/natri cho màu xanh lam. K2O có thể làm cho men có CuO ngả sắc vàng.
7. Tính chất hóa học của HNO3
– Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
– Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
– Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
– Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
– Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
– Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
– Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
– Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
– Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
– Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
8. Bài tập vận dụng liên quan
Câu 1. Cho các mô tả sau:
(1). Hoà tan Cu bằng dung dịch HCl đặc nóng giải phóng khí H2
(2). Ðồng dẫn nhiệt và dẫn điện tốt, chỉ thua Ag
(3). Ðồng kim loại có thể tan trong dung dịch FeCl3
(4). Có thể hoà tan Cu trong dung dịch HCl khi có mặt O2
(5). Ðồng thuộc nhóm kim loại nhẹ (d = 8,98 g/cm3)
(6). Không tồn tại Cu2O; Cu2S
Số mô tả đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
1. Sai vì Cu không tác dụng với HCl.
2. Đúng
3. Đúng, Cu + 2FeCl3 → CuCl2 + 2FeCl2
4. Đúng, 2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
5. Sai, đồng thuộc nhóm kim loại nặng
6. Sai, có tồn tại 2 chất trên
Câu 2. Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
A. 2.
B. 3.
C. 4.
D. 1.
Lời giải:
2Cu(NO3)2 → 2CuO + 4NO2 (4x) + O2 (x mol)
Áp dụng định luật bảo toàn khối lượng có:
mchất rắn ban đầu = mchất rắn sau + mkhí
→ 6,58 = 4,96 + 46.4x + 32x → x = 0,0075 mol
Dẫn khí X vào nước
O2 (0,0075) + 4NO2 (0,03) + 2H2O → 4HNO3 (0,03 mol)
CM (HNO3) =0,030,3 = 0,1 → pH = 1.
Câu 3. Cho các dung dịch: HCl, NaOH đặc, NH3, KCl. Số dung dịch phản ứng được với Cu(OH)2 là
A. 1.
B. 3.
C. 2.
D. 4.
Lời giải:
2HCl + Cu(OH)2 → CuCl2 + 2H2O
4NH3 + Cu(OH)2 → |Cu(NH3)|4(OH)2
Câu 4. Nhúng một thanh Fe nặng 200 gam vào 200 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 203,44 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh Fe). Khối lượng Fe đã phản ứng là
A. 2,16 gam.
B. 0,84 gam.
C. 1,72 gam.
D. 2,80 gam.
Lời giải:
Fe + 2Ag+ → Fe2+ + 2Ag (1)
0,04 0,04 mol
mtăng (1) = 0,04.108 – 0,02.56 = 3,2 gam
Theo bài ra mKL tăng = 203,44 – 200 = 3,44 gam.
Phản ứng:
Fe + Cu2+ → Fe2+ + Cu
a a mol
mtăng (2) = 64a – 56a = 3,44 – 3,2 → a = 0,03 mol
→ mFe = (0,02 + 0,03).56 = 2,8 gam.
Câu 5. Cho luồng khí CO (dư) đi qua 18,2 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 16,6 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
A. 0,8 gam.
B. 8,0 gam.
C. 2,0 gam.
D. 4,0 gam
Lời giải:
Hỗn hợp gồm CuO và Al2O3 chỉ có CuO phản ứng với CO
Phương trình hóa học
CuO + CO → Cu + CO2
a a a a mol
Áp dụng định luật bảo toàn khối lượng có:
mchất rắn ban đầu + mCO pư = mchất rắn sau+ mCO2
→ 18,2 + 28x = 16,6 + 44x → a = 0,1 mol
→ mCuO = 0,1.80 = 8 gam.
Xem thêm các phương trình hóa học khác:
CuSO4 + NaOH → Cu(OH)2 + Na2SO4
Cu(OH)2 + H2SO4 → CuSO4 + H2O
Ag + O3 → Ag2O + O2
O3 + KI + H2O → KOH + I2 + O2
Al + FeCl3 → AlCl3 + Fe
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




