Phản ứng Cu(OH)2 + H2SO4 → CuSO4 + H2O
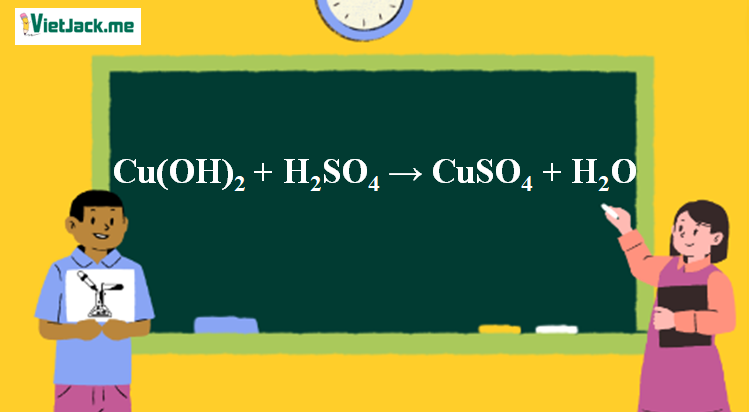
1. Phương trình phản ứng Cu(OH)2 tác dụng H2SO4
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
2. Phương trình ion rút gọn Cu(OH)2 + H2SO4
Phương trình ion rút gọn:
Cu(OH)2 + 2H+→ Cu2+ + 2H2O
3. Điều kiện phản ứng Cu(OH)2 tác dụng H2SO4
Không có
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Cu(OH)2 (Đồng hidroxit)
Cu(OH)2 có đầy đủ tính chất hóa học của hidroxit không tan nên tác dụng được với axit.
4.2. Bản chất của H2SO4 (Axit sunfuric)
H2SO4 là một bazo mạnh phản ứng được với bazo.
5. Hiện tượng phản ứng Cu(OH)2 tác dụng H2SO4
Cho vào đáy ống nghiệm một ít bazơ Cu(OH)2. Thêm 1-2 ml dung dịch axit và lắc nhẹ. Sau phản ứng chất rắn màu xanh lam đồng II hidroxit Cu(OH)2 tan dần, tạo thành dung dịch màu xanh lam.
6. Tính chất hoá học của Cu(OH)2
Có đầy đủ tính chất hóa học của hidroxit không tan.
6.1. Tác dụng với axit
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
6.2. Phản ứng nhiệt phân
Cu(OH)2  CuO + H2O
CuO + H2O
6.3. Tạo phức chất, hòa tan trong dung dịch amoniac
Cu(OH)2 + NH3 → [Cu(NH3)4]2+ + 2OH-
6.4. Tạo phức chất, hòa tan trong ancol đa chức có nhiều nhóm –OH liền kề
Cu(OH)2 + 2C3H5(OH)3 → [C3H5(OH)2O]2Cu + 2H2O
6.5. Phản ứng với anđehit
2Cu(OH)2 + NaOH + HCHO  HCOONa + Cu2O↓ + 3H2O
HCOONa + Cu2O↓ + 3H2O
6.6. Phản ứng màu biure
Trong môi trường kiềm, peptit tác dụng với Cu(OH)2 cho hợp chất màu tím. Đó là màu của phức chất tạo thành giữa peptit có từ hai liên kết peptit trở lên tác dụng với ion đồng.
6.7. Ứng dụng
Dung dịch đồng(II) hydroxide trong amonia, với tên khác là thuốc thử Schweizer, có khả năng hòa tan cellulose. Tính chất này khiến dung dịch này được dùng trong quá trình sản xuất rayon, một cellulose fiber.
Nó cũng được sử dụng rộng rãi trong ngành công nghiệp thủy sinh vì khả năng tiêu diệt các ký sinh bên ngoài trên cá, bao gồm sán, cá biển, brook và nhung biển, mà không giết chết cá. Mặc dù các hợp chất đồng hòa tan trong nước có thể có hiệu quả trong vai trò này, chúng thường dẫn đến mức độ tử vong cao ở cá.
Đồng(II) hydroxide đã được sử dụng như là một sự thay thế cho hỗn hợp Bordeaux, một thuốc diệt nấm và nematicide.
7. Tính chất hoá học của H2SO4
7.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
7.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
8. Bài tập vận dụng liên quan
Câu 1. Hợp chất nào sau đây có tính lưỡng tính?
A. Al(OH)3.
B. Cu(OH)2.
C. Fe(OH)2.
D. Cr(OH)2.
Lời giải:
Câu 2. Các dung dịch KCl, HCl, HCOOH, H2SO4 có cùng nồng độ mol, dung dịch có pH nhỏ nhất là
A. HCl.
B. HCOOH.
C. KCl.
D. H2SO4.
Lời giải:
Câu 3. Để phân biệt dung dịch H2SO4 với dung dịch HCl, người ta dùng dung dịch
A. KOH.
B. NaNO3.
C. KNO3.
D. BaCl2.
Lời giải:
Câu 4. Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và CuSO4.
B. Cu(OH)2 và H2SO4 .
C. NaAlO2 và HCl.
D. NaHSO4 và NaHCO3.
Lời giải:
Xem thêm các phương trình hóa học khác:
Ag + O3 → Ag2O + O2
O3 + KI + H2O → KOH + I2 + O2
Al + FeCl3 → AlCl3 + Fe
Al + Fe2O3 → Al2O3 + Fe
Al + H2O + NaOH → NaAlO2 + H2
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




