Phản ứng Fe + H2SO4 → Fe2(SO4)3 + S + H2O
1. Phương trình phản ứng
2Fe + 4H2SO4 → Fe2(SO4)3 + S + 2H2O
2. Điều kiện phản ứng
– Dung dịch H2SO4 đặc nóng dư.
3. Cách thực hiện phản ứng
Cho kim loại sắt tác dụng với dung dịch axit sunfric đặc nóng
4. Hiện tượng nhận biết phản ứng
Kim loại tan dần tạo thành dung dịch màu vàng nâu và kết tủa màu vàng.
5. Bạn có biết
Khi cho sắt tác dụng với axit sunfuric đặc nóng có thể tạo ra sản phẩm khử là khí SO2; H2S và S.
6. Tính chất hóa học của sắt
Sắt là kim loại có tính khử trung bình. Khi tác dụng với chất oxi hóa yếu, sắt bị oxi hóa đến số oxi hóa +2.
Fe → Fe+2 + 2e
Với chất oxi hóa mạnh, sắt bị oxi hóa đến số oxi hóa +3.
Fe → Fe+3 + 3e
6.1. Tác dụng với phi kim
Ở nhiệt độ cao, sắt khử nguyên tử phi kim thành ion âm và bị oxi hóa đến số oxi hóa +2 hoặc +3.
+ Tác dụng với lưu huỳnh: Fe0+S0→toFe+2S−2
+ Tác dụng với oxi: 3Fe+2O20→toFe3O−24

+ Tác dụng với clo: 2Fe0+3Cl20→to2Fe+3Cl−13
6.2. Tác dụng với axit
– Với dung dịch HCl, H2SO4 loãng, Fe bị oxi hóa đến số oxi hóa +2, giải phóng H2. Ví dụ:
Fe + H2SO4 → FeSO4 + H2
– Với dung dịch HNO3 và H2SO4 đặc nóng, Fe bị oxi hóa đến số oxi hóa +3, và không giải phóng H2. Ví dụ:
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
Chú ý: Fe bị thụ động bởi các axit HNO3 đặc, nguội và H2SO4 đặc, nguội.
6.3. Tác dụng với dung dịch muối
Fe có thể khử được ion của các kim loại đứng sau nó trong trong dãy điện hóa của kim loại. Trong các phản ứng này, Fe thường bị oxi hóa đến số oxi hóa +2. Ví dụ:
Fe + CuSO4 → FeSO4 + Cu
Đặc biệt:
Fe + 2Ag+ → Fe2+ + 2Ag
Nếu Ag+ dư, tiếp tục có phản ứng:
Fe2+ + Ag+ → Fe3+ + Ag
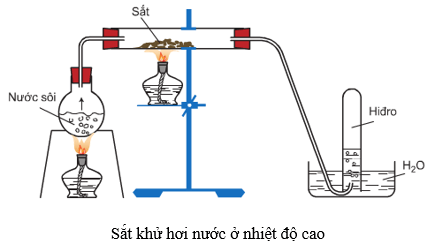
6.4. Tác dụng với nước
Ở nhiệt độ thường, sắt không khử được nước, nhưng ở nhiệt độ cao, sắt khử hơi nước tạo ra H2 và Fe3O4 hoặc FeO.
3Fe + 4H2O →to<570oC Fe3O4 + 4H2
Fe + H2O →to>570oCFeO + H2
7. Tính chất vật lí của Sắt
– Màu xám hơi trắng, dễ ràn và dẻo cũng như có thể dát mỏng hay kéo sợi, khả năng dẫn điện và nhiệt không bằng nhôm hay đồng.
– Nhiễm từ ở nhiệt độ cao khoảng 800 độ C sẽ nhiễm từ và mất từ tính.
8. Bài tập vận dụng
Câu 1: Khi cho sắt tác dụng với axit sunfuric đặc nóng thu được kết tủa màu vàng. Phương trình hóa học xảy ra là:
A. 2Fe + 4H2SO4 → Fe2(SO4)3 + S + 2H2O
B. 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
C. 8Fe + 15H2SO4 → 4Fe2(SO4)3 + 3H2S + 12H2O
D. Fe + H2SO4 → FeSO4 + H2O
Hướng dẫn giải
Đáp án A
Kết tủa màu vàng là S
Câu 2: Khi cho sắt tác dụng với axit sunfuric đặc nóng, các sản phẩm khử có thể có là:
A. H2 B. SO2 C. S D. Cả B và C
Hướng dẫn giải
Đáp án D
Phương trình phản ứng: 2Fe + 4H2SO4 → Fe2(SO4)3 + S + 2H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Câu 3: Cho phản ứng sau: 2Fe + 4H2SO4 → Fe2(SO4)3 + S + 2H2O Tổng hệ số tối giản của phản ứng trên là:
A. 8 B. 9 C.10 D. 11
Hướng dẫn giải
Đáp số C
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




