Phản ứng: HCl + HClO → Cl2 + H2O
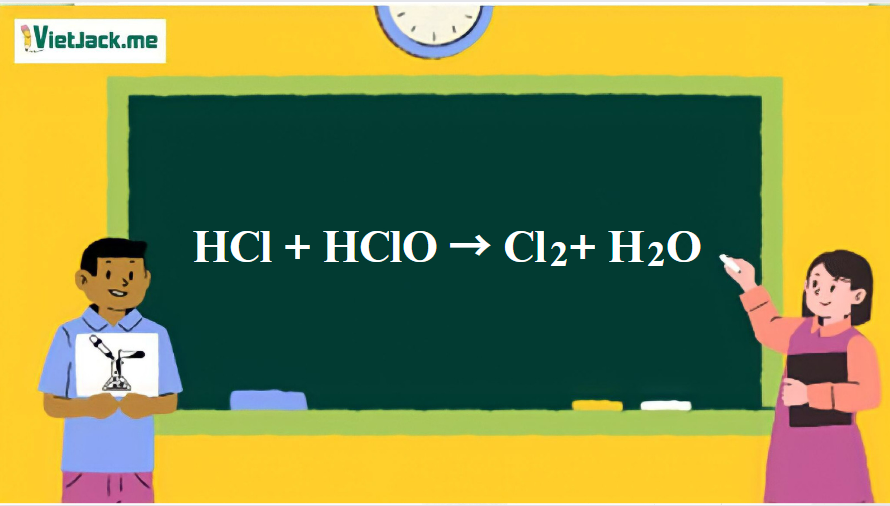
1. Phương trình phản ứng hóa học giữa HCl và HClO
HCl + HClO → Cl2 + H2O
2. Điều kiện xảy ra phản ứng
Không có
3. Cách thức thực hiện phản ứng HCl và HClO
Cho HCl tác dụng với HClO
4. Hiện tượng nhận biết nếu phản ứng xảy ra
Dẫn khí clo vào cốc nước, nhúng mẫu giấy quỳ tím vào dung dịch thu được.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
5.2 Bản chất của HClO
Axit hipoclorơ phản ứng với axit clohiđric để giải phóng khí clo:
6. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
6.1 Tác dụng chất chỉ thị:
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl–
6.2 Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl  FeCl2 + H2
FeCl2 + H2
2Al + 6HCl  2AlCl3 + 3H2
2AlCl3 + 3H2
Cu + HCl → không có phản ứng
6.3 Tác dụng với oxit bazo và bazo:
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl  CuCl2 + H2 O
CuCl2 + H2 O
Fe2 O3 + 6HCl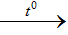 2FeCl3 + 3H2 O
2FeCl3 + 3H2 O
6.4 Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 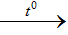 MnCl2 + Cl + 2H2 O
MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
7. Tính chất hóa học của HClO
– Trong dung dịch hay ở dạng ngậm nước, axit hypochlorous đều có thể bị phân giải riêng biệt thành anion hipoclorit:
-
- HClO
 OCl− + H+
OCl− + H+
- HClO
– Axit hipoclorơ phản ứng với axit clohiđric để giải phóng khí clo:
-
- HClO + HCl → H2O + Cl2
– HClO có tính oxi hoá mạnh hơn khi khí Clo ở điều kiện chuẩn:
-
- 2 HClO + 2 H+ + 2 e−
 Cl2 + 2 H2O
Cl2 + 2 H2O
- 2 HClO + 2 H+ + 2 e−
– Các muối HClO được gọi là các hipoclorit. Một trong những hipocloríc được biết đến nhiều nhất là NaClO, một chất độn hoạt động rất mạnh trong các chất tẩy rửa.
8. Tính chất vật lí của HClO
Ngoại quan: chất lỏng không màu
Khối lượng phân tử: 52.46 g/mol
Tan được trong nước
Là một chất oxi hóa mạnh và có thể gây nên các vụ nổ hóa chất
9. Bài tập vận dụng liên quan
Câu 1. Dãy gồm các chất đều là chất điện li yếu là
A. Na2SO3, NaOH, CaCl2, HClO
B. H2S, HClO, CH3COOH, Fe(OH)2.
C. BaSO4, H2S, CaCO3, AgCl.
D. CuSO4, NaCl, HCl, NaOH.
Đáp án B
Dãy gồm các chất đều là chất điện li yếu là H2S, HClO, CH3COOH, Fe(OH)2.
Phương trình điện li minh họa
H2S ⇄ H+ + HS−
HS− ⇆ H+ +S2−
HClO ⇌ H+ + ClO–
CH3COOH ⇔ CH3COO– + H+
Fe(OH)2 ⇌ Fe2+ + OH–
Câu 2. Dung dịch nào sau đây dẫn điện tốt nhất? Biết chúng đều có cùng nồng độ mol là 0,2M.
A. KOH
B. BaCl2
C. H2S
D. HF
Đáp án B
Câu 3. Dãy nào dưới dây chỉ gồm chất điện li mạnh?
A. HClO, Na2S, Ba(OH)2, K2CO3.
B. H2SO4, NaOH, NaCl, HClO.
C. HNO3, Na2SO4, KOH, K2SiO3.
D. Ba(OH)2, NaOH, HClO, NaCl.
Đáp án C
Dãy chỉ gồm chất điện li mạnh là: HNO3, Na2SO4, KOH, K2SiO3.
Phương trình điện li
HNO3 → H++ NO3−
Na2SO4 → 2Na+ + SO42-
KOH → K+ + OH−
K2SiO3→ 2K+ + SiO32-
Câu 4. Chất nào sau đây, trong nước đều là chất điện li yếu?
A. HCl
B. Ba(OH)2.
C. HClO
D. H2SO4
Đáp án C
Câu 5. Cho dãy các chất: KAl(SO4)2.12H2O, C2H5OH, C12H22O11 (saccarozơ), CH3COOH, Ca(OH)2, CH3COONH4. Số chất điện li là
A. 3
B. 4
C. 5
D. 2
Đáp án B
Chất không điện li: C2H5OH, C12H22O11 (saccarozơ) khi tan trong nước không phân li ra được các ion nên dung dịch không dẫn được điện
* Chất điện li: KAl(SO4)2.12H2O, CH3COOH, Ca(OH)2, CH3COONH4
KAl(SO4)2.12H2O → K++Al3++ 2SO42−+ 12H2O
CH3COOH ⇆ CH3COO−+ H+
Ca(OH)2→Ca2+ + 2OH−
CH3COONH4 → CH3COO− + NH4+
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




