Phản ứng K + Fe(NO3)2 + H2O → KNO3 + H2 + Fe(OH)2
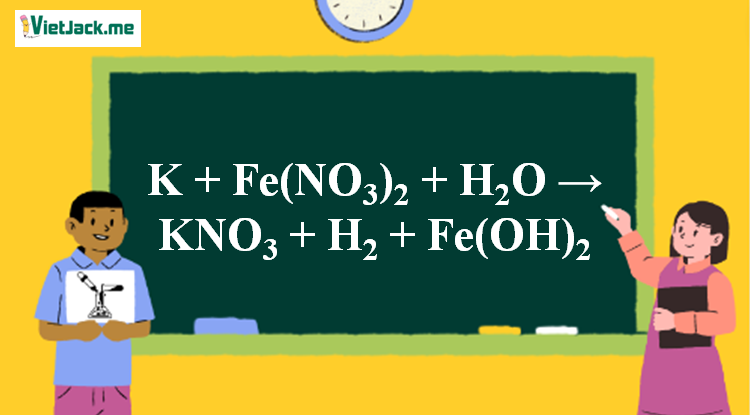
1. Phản ứng hóa học
2K + Fe(NO3)2 + 2H2O → 2KNO3 + H2 + Fe(OH)2
2. Điều kiện phản ứng
Không cần điều kiện
3. Cách thực hiện phản ứng
Cho kali tác dụng với dung dịch muối sắt(II) nitrat
4. Hiện tượng nhận biết phản ứng
K tan dần trong dung dịch muối sắt(II)nitrat, có kết tủa màu trắng xanh tạo thành và có khí thoát ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K (Kali)
– Trong phản ứng trên K là chất khử.
– K là chất khử mạnh, K tham gia phản ứng với các dung dịch muối sẽ tham gia phản ứng với nước trước tạo hidroxit.
5.2. Bản chất của Fe(NO3)2 (Sắt (II) nitrat)
Fe(NO3)2 mang tính chất hóa học của muối nên tác dụng được với dung dịch bazơ.
6. Tính chất hoá học của K
Kali là kim loại kiềm có tính khử rất mạnh.
K → K+ + 1e
6.1. Tác dụng với phi kim
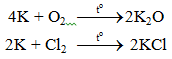
6.2. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
6.3. Tác dụng với nước
K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
6.4. Tác dụng với hidro
Kali tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
7. Tính chất hóa học của Fe(NO3)2
– Mang đầy đủ tính chất hóa học của muối.
– Có tính khử và tính oxi hóa:
Tính khử: Fe2+ → Fe3+ + 1e
Tính oxi hóa: Fe2+ + 1e → Fe
7.1. Tính chất hóa học của muối
Tác dụng với dung dịch kiềm:
Fe(NO3)2 + Ba(OH)2 → Ba(NO3)2 + Fe(OH)2
7.2. Tính khử
Thể hiện tính khử khi tác dụng với các chất oxi hóa:
Fe(NO3)2 + 2HNO3 → H2O + NO2 + Fe(NO3)3
AgNO3 + Fe(NO3)2 → Ag + Fe(NO3)3
3Fe(NO3)2 + 4HNO3 → 3Fe(NO3)3 + NO + 2H2O
7.3. Tính oxi hóa
Thể hiện tính khử khi tác dụng với các chất khử mạnh:
FeCl2 + Mg → MgCl2 + Fe
7.4. Điều chế
– Cho kim loại Fe dư tác dụng với axit HNO3
3Fe + 8HNO3 → 4H2O + 2NO + 3Fe(NO3)2
8. Câu hỏi vận dụng
Câu 1. Khi cho K tác dụng với dung dịch muối sắt(II)nitrat. Phương trình phản ứng xảy ra là:
A. 2K + Fe(NO3)2 + 2H2O → 2KNO3 + H2 + Fe(OH)2
B. 2K + Fe(NO3)2 → KNO3 + Fe
C. 2K + Fe(NO3)2 + 2H2O → KNO3 + H2 + Fe
D. 2K + Fe(NO3)2 → KNO3 + Fe(NO3)3
Lời giải:
Đáp án A
Câu 2. Khi cho K tác dụng với 200 ml dung dịch muối sắt(II)nitrat thu được 9 g kết tủa. Nồng độ dung dịch sắt(II)nitrat là:
A. 1M B. 2M
C. 0,5M D. 0,25 M
Lời giải:
Đáp án C
Phương trình phản ứng: 2K + Fe(NO3)2 + 2H2O → 2KNO3 + H2 + Fe(OH)2
nFe(NO3)2 = nFe(OH)2 = 9/90 = 0,1 mol ⇒ CM Fe(NO3)2 = 0,1/0,2 = 0,5 M
Câu 3. Cho K tác dụng với dung dịch Fe(NO3)2 thu được V lít khí thoát ra đktc. Cho toàn bộ khí thoát ra tác dụng với Oxi dư thu được 1,8 g nước. Giá trị của V là:
A. 2,24 lít B. 1,12 lít
C. 5,6 lít D. 3,36 lít
Lời giải:
Đáp án A
Hướng dẫn giải:
Phương trình hóa học:
2K + Fe(NO3)2 + 2H2O → 2KNO3 + H2 + Fe(OH)2
2H2 + O2 → 2H2O
nH2 = 2nH2O = 2 .0,1 = 0,2 mol
nH2 = nK/2 = 0,2/2 = 0,1 mol ⇒ VH2 = 0,1.22,4 = 2,24 lít
Xem thêm các phương trình phản ứng hóa học khác:
K + Al(NO3)3 + H2O → KNO3 + H2 + Al(OH)3
K + Zn(NO3)2 + H2O → KNO3 + H2 + Zn(OH)2
K + Pb(NO3)2 + H2O → KNO3 + H2 + Pb(OH)2
K + Fe(NO3)3 + H2O → KNO3 + H2 + Fe(OH)3
K + C2H5OH → C2H5OK + H2
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




