Phản ứng KOH + Ca(HCO3)2 → K2CO3 + CaCO3 + H2O
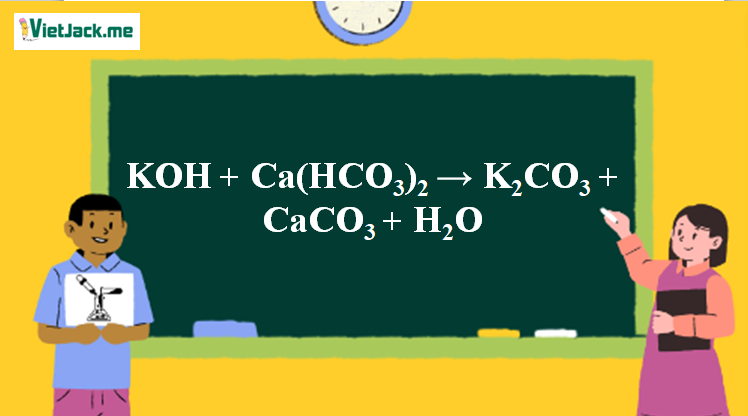
1. Phản ứng hóa học
2KOH + Ca(HCO3)2 → K2CO3 + CaCO3 + 2H2O
2. Điều kiện phản ứng
Phản ứng xảy ra ngay điều kiện thường.
3. Cách thực hiện phản ứng
Nhỏ từ từ dung dịch KOH vào ống nghiệm chứa Ca(HCO3)2
4. Hiện tượng nhận biết phản ứng
Thu được kết tủa trắng.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của KOH (Kali hidroxit)
KOH là một bazo mạnh, KOH có thể phản ứng với các muối hiđrocacbonat của Ba, Ca để thu được muối cacbonat kết tủa.
5.2. Bản chất của Ca(HCO3)2 (Canxi hidrocacbonat)
Ca(HCO3)2 là muối tác dụng được với dung dịch bazơ.
6. Tính chất hoá học của KOH
KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
6.1. Tác dụng với oxit axit
Ở điều kiện nhiệt độ phòng, KOH tác dụng với SO2, CO2,…
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
6.2. Tác dụng với axit
-
Tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
-
Tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
6.3. Tác dụng với kim loại
KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới.
KOH + Na → NaOH + K
6.4. Tác dụng với muối
KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
6.5. KOH điện li mạnh
KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion K+ và OH-
6.6. KOH phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính
KOH phản ứng được với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
6.7. Phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
7. Tính chất hóa học của Ca(HCO3)2
7.1. Tính chất vật lí & nhận biết
– Tính chất vật lí: Tồn tại trong dung dịch dưới dạng trong suốt, với hai ion Ca2+ và HCO3–.
– Nhận biết: sử dụng dung dịch axit HCl, thấy thoát ra khí không màu, không mùi:
Ca(HCO3)2 + 2HCl → CaCl2 + 2H2O + 2CO2
7.2. Tính chất hóa học
– Tác dụng với axit mạnh
Ca(HCO3)2 + H2SO4 → CaSO4 + 2H2O + 2CO2
– Tác dụng với dung dịch bazơ
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
– Bị phân hủy bởi nhiệt độ:
Ca(HCO3)2 –to→ CaCO3 + H2O + CO2
7.3. Điều chế
Sục CO2 đến dư vào dung dịch Ca(OH)2
2CO2 + Ca(OH)2 → Ca(HCO3)2
7.4. Ứng dụng
– Trong ngành công nghiệp thực phẩm: Ca(HCO3)2 được sử dụng rộng rãi làm chất điều chỉnh độ axit trong thực phẩm. Nó có khả năng điều chỉnh pH và ổn định độ axit, giúp tạo ra một môi trường lý tưởng cho quá trình sản xuất và bảo quản thực phẩm.
– Trong ngành xử lý nước: Ca(HCO3)2 được sử dụng như một chất xử lý nước, để điều chỉnh và ổn định độ kiềm và pH của nước. Nó có khả năng giảm sự tạo cặn và mục nát trong các hệ thống cấp nước và hệ thống cơ sở xử lý nước.
– Trong ngành nông nghiệp: Ca(HCO3)2 được sử dụng trong việc điều chỉnh độ kiềm và pH của đất. Nó có thể giúp cung cấp canxi cho cây trồng và cải thiện cấu trúc đất, tăng cường khả năng hấp thụ và sử dụng chất dinh dưỡng cho cây trồng.
– Trong sinh học: Ca(HCO3)2 cũng được sử dụng trong nghiên cứu sinh học, đặc biệt là trong việc điều chỉnh pH và cung cấp canxi trong một số loại môi trường nuôi cấy tế bào, chẳng hạn như trong nuôi cấy tế bào mô phôi.
8. Câu hỏi vận dụng
Câu 1. KOH không thể phản ứng với muối nào sau?
A. Ba(HSO3)2. B. Ca(HSO3)2. C. Ca(HCO3)2 . D. CaCO3.
Lời giải:
KOH không thể phản ứng với CaCO3.
Đáp án D.
Câu 2. KOH phản ứng với chất nào sau không thu được kết tủa?
A. CuCl2. B. Ca(HCO3)2. C. KHCO3. D. MgCl2.
Lời giải:
KOH + KHCO3 → K2CO3 + H2O
K2CO3 tan trong nước.
Đáp án C.
Câu 3. Cho 0,01 mol KOH phản ứng hoàn toàn Ca(HCO3)2 thu được khối lượng kết tủa là
A. 2,17g. B. 0,50g. C. 1,00g. D. 1,97g.
Lời giải:
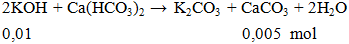
khối lượng kết tủa = 0,005.100=0,5g
Đáp án B.
Xem thêm các phương trình hóa học khác:
KOH + Ca(HSO3)2 → K2SO3 + CaSO3 + H2O
KOH + Cl2 → KCl + KClO + H2O
KOH + Al2O3 → KAlO2 + H2O
KOH + ZnO → K2ZnO2 + H2O
KOH + H2S → K2S + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




