Phản ứng Li + CH3OH → CH3OLi + H2
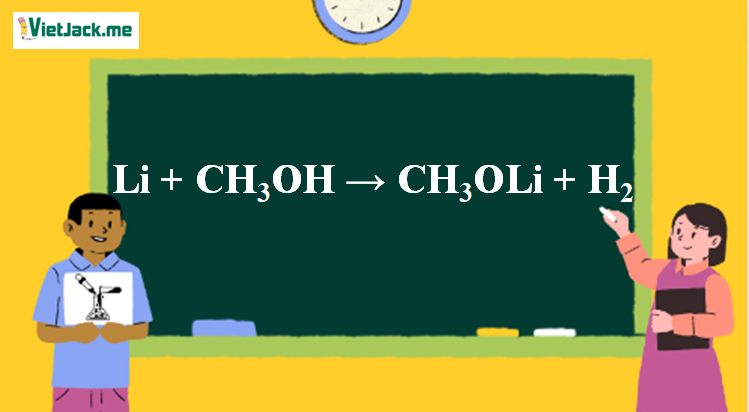
1. Phản ứng hóa học
2Li + 2CH3OH → 2CH3OLi + H2
2. Điều kiện phản ứng
Không cần điều kiện
3. Cách thực hiện phản ứng
Cho Li tác dụng với rượu methanol.
4. Hiện tượng nhận biết phản ứng
Cho Li tác dụng với rượu methanol.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Li (Liti)
– Trong phản ứng trên Li là chất khử.
– Li tham gia phản ứng rượu giải phóng H2 tương tự nước nhưng phản ứng yếu hơn nước.
5.2. Bản chất của CH3OH (Metanol)
– Trong phản ứng trên CH3OH là chất oxi hóa.
– CH3OH phản ứng được với kim loại kiềm.
6. Tính chất hóa học của Li
Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
6.1. Tác dụng với phi kim
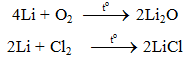
6.2. Tác dụng với axit
Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng…) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
6.3. Tác dụng với nước
Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
6.4. Tác dụng với hidro
Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
7. Tính chất vật lý của Li
– Kim loại kiềm. Trắng – bạc. Nhẹ nhất trong các kim loại, mềm, dễ nóng chảy.
– Có khối lượng riêng là 0,534 g/cm3; có nhiệt độ nóng chảy là 180,50C và sôi ở 1336,60C
8. Tính chất hoá học của ancol
8.1. Phản ứng thế nguyên tử hiđro của nhóm OH ancol
Đây là phản ứng đặc trưng của Ancol
– Tính chất chung của ancol:
2ROH + Na → 2RONa + H2↑
– Tính chất đặc trưng của glixerol:
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + H2O
(ĐK: muốn tác dụng với Cu(OH)2 phải có 2 nhóm -OH trở lên liền kề nhau)
→ Phản ứng này dùng để phân biệt ancol đơn chức với ancol đa chức có 2 nhóm OH cạnh nhau trong phân tử.
8.2. Phản ứng thế nhóm OH
– Phản ứng với axit vô cơ:
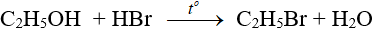
– Phản ứng tạo dien: dùng sản xuất cao su buna.
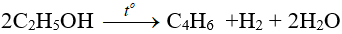
(ĐK: phải có xúc tác là Al2O3 + MgO hoặc ZnO/500ºC)
8.3. Phản ứng tách nước
Đây là phản ứng đề hidrat hoá
Chú ý:
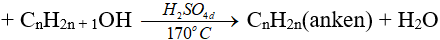
(ĐK n ≥ 2, theo quy tắc Zai-xép)
(ancol bậc càng cao thì càng dễ khử nước tạo anken)
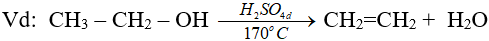
(phải là rượu no, đơn chức)
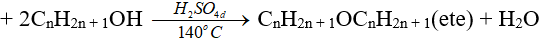
(ancol bậc càng thấp thì càng dễ khử nước tạo ete)
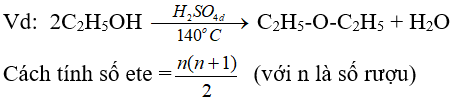
8.4. Phản ứng oxi hoá
– Phản ứng oxi hoá hoàn toàn:
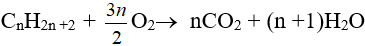
– Phản ứng oxi hoá không hoàn toàn:
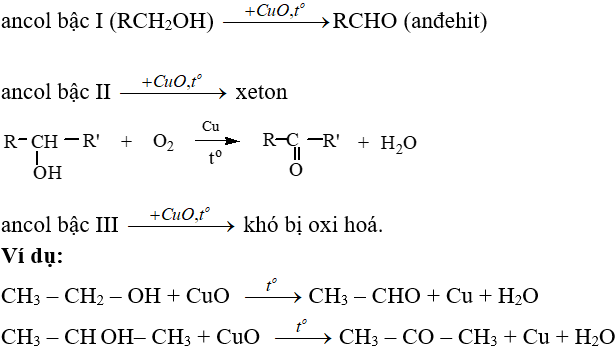
9. Câu hỏi vận dụng
Câu 1. Cho 10 ml dung dịch ancol metylic 340 tác dụng với Na dư. Xác định thể tích H2 tạo thành? (biết khối lượng riêng của ancol metylic là 0,76 g/ml)
A. 2,128 lít B. 0,896 lít C. 3,360 lít D. 4,9616 lít
Lời giải:
Đáp án: D
2Li + 2CH3OH → 2CH3OLi + H2
VCH3OH = 3,4 ml
mCH3OH = 3,4 . 0,76 = 2,584 (g) ⇒ nCH3OH = 0,076 mol
VH2O = 10 – 3,4 = 6,6 ml ; mH2O = 6,6 . 1 = 6,6 g
⇒ nH2O = 6,6/18 = 0,367
VH2 = (0,076 + 0,367) . 22,4/2 = 4,9616 (lít)
Câu 2. Cho Li tác dụng với các chất sau: H2O; CH3OH; CH3COOH; Na2SO4; KOH rắn; Fe; K. Số phản ứng cho sản phẩm là chất khí là:
A. 1 B. 2 C. 3 D. 4
Lời giải:
Đáp án: D
2Li + H2O → 2KOH + H2
2Li + 2CH3OH → CH3OK + H2
2Li + 2CH3COOH → 2CH3COOK + H2
Câu 3. Cho Li tác dụng với dung dịch CH3OH thu được 22,4 lít khí đktc. Khối lượng CH3OH tham gia phản ứng là:
A. 6,4 g B. 3,2 g C. 1,6 g D. 12,8 g
Lời giải:
Đáp án: A
2Li + 2CH3OH → 2CH3OLi + H2
nH2O = 2nCH3OH = 2.0,1= 0,2 mol → mCH3OH = 0,2.32 = 6,4 g
Xem thêm các phương trình phản ứng hóa học khác:
Li + CH3COOH → CH3COOLi + H2
Li + C6H5OH → C6H5OLi + H2
Li + N2 → Li3N
Li + H2 → LiH
Li + Cl2 → LiCl
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




