Phản ứng Li + H3PO4 → LiH2PO4 + H2
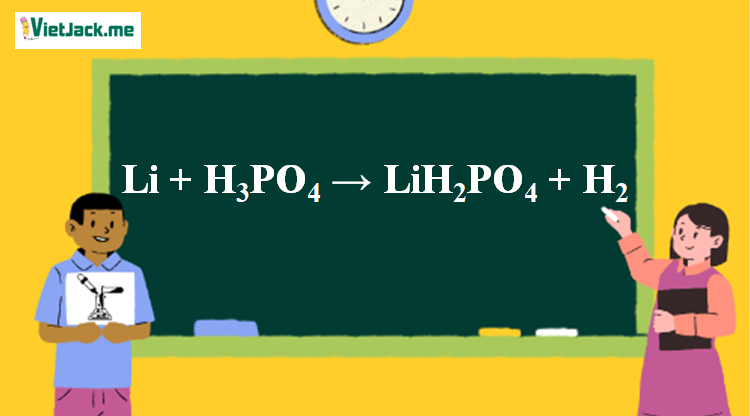
1. Phản ứng hóa học
2Li + 2H3PO4 → 2LiH2PO4 + H2
2. Điều kiện phản ứng
Không cần điều kiện
3. Cách thực hiện phản ứng
Cho Li tác dụng với H3PO4 tạo muối.
4. Hiện tượng nhận biết phản ứng
Liti tan dần trong dung dịch H3PO4 và có khí thoát ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Li (Liti)
– Trong phản ứng trên Li là chất khử.
– Li có tính khử rất mạnh, dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng thành hidro tự do.
5.2. Bản chất của H3PO4 (Axit photphoric)
– Trong phản ứng trên H3PO4 là chất oxi hóa.
– H3PO4 tác dụng với kim loại đứng trước H2 tạo thành muối và giải phóng khí H2.
6. Tính chất hóa học của Li
Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
6.1. Tác dụng với phi kim
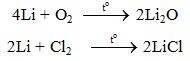
6.2. Tác dụng với axit
Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng…) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
6.3. Tác dụng với nước
Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
6.4. Tác dụng với hidro
Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
7. Tính chất vật lý của Li
– Kim loại kiềm. Trắng – bạc. Nhẹ nhất trong các kim loại, mềm, dễ nóng chảy.
– Có khối lượng riêng là 0,534 g/cm3; có nhiệt độ nóng chảy là 180,50C và sôi ở 1336,60C
8. Tính chất hóa học của H3PO4
8.1. Tính oxi hóa – khử
Axít photphoric khó bị khử (do P ở mức oxi hóa +5 bền hơn so với N trong axit nitric), không có tính oxi hóa.
8.2. Tính axit
Axít photphoric là axit có 3 lần axit, có độ mạnh trung bình. Trong dung dịch nó phân li ra 3 nấc:
H3PO4 ⇋ H+ + H2PO4– ⇒ k1 = 7, 6.10-3
H2PO4– ⇋ H+ + HPO42- ⇒ k2 = 6,2.10-8
HPO42- ⇋ H+ + PO43- ⇒ k3 = 4,4.10-13
⇒ nấc 1 > nấc 2 > nấc 3.
⇒ Dung dịch axít photphoric có những tính chất chung của axit như làm quì tím hóa đỏ, tác dụng với oxit bazơ, bazơ, muối, kim loại.
⇒ Khi tác dụng với oxit bazơ, bazơ tùy theo lượng chất tác dụng mà axít photphoric tạo ra muối trung hòa, muối axit hoặc hỗn hợp muối:
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O
9. Câu hỏi vận dụng
Câu 1. Cho Li tác dụng vừa đủ với 100 g dung dịch H3PO4 17,64 % thu được muối Liti hidrophotphat. Khối lượng muối thu được là:
A. 18,54 g B. 10,3 g C. 20,6 g D. 5,15 g
Lời giải:
Đáp án: A
Phương trình hóa học: 2Li + H3PO4 → Li2HPO4 + H2
nLi2HPO4 = nH3PO4 = 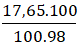 = 0,18 mol
= 0,18 mol
⇒ mLi2HPO4 = 0,18.103 = 18,54 g
Câu 2. Cấu hình electron nào giống khí hiếm
A. Li+ B. Fe2+ C. Ag+ D. Cr2+
Lời giải:
Đáp án: A
Câu 3. Cho 1,4 g Li tác dụng với dung dịch axit photphoric thu được muối litihidrophotphat và V lít khi đktc. Giá trị của V là
A. 1,12 lít B. 2,24 lít C. 11,2 lít D. 5,6 lít
Lời giải:
Đáp án: B
Phương trình hóa học: 2Li + H3PO4 → Li2HPO4 + H2
nH2 = nLi/2 = 0,2/2 = 0,1 mol ⇒ VH2 = 0,1.22,4 = 2,24 lít
Xem thêm các phương trình phản ứng hóa học khác:
Li + C2H5OH → C2H5OLi + H2
Li + CH3OH → CH3OLi + H2
Li + CH3COOH → CH3COOLi + H2
Li + C6H5OH → C6H5OLi + H2
Li + N2 → Li3N
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




