Phản ứng MnO2 + HCl → MnCl2 + Cl2 + H2O
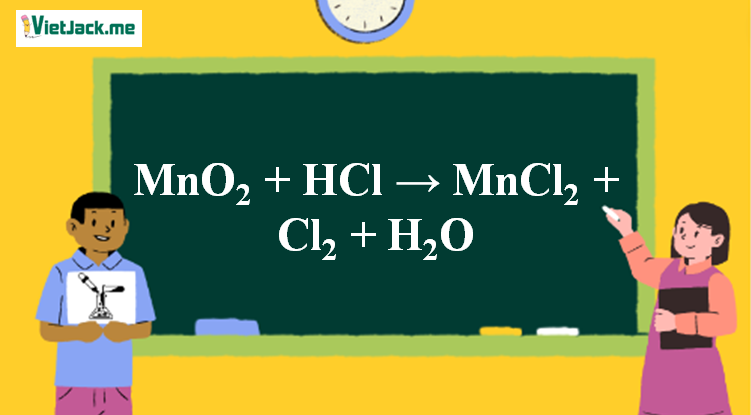
1. Điều chế khí Clo trong phòng thí nghiệm
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2. Điều kiện để phản ứng MnO2 ra Cl2
Nhiệt độ
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của MnO2 (Mangan dioxit)
– Trong phản ứng trên MnO2 là chất oxi hoá.
– Khi MnO2 tan trong dung dịch axit, nó không tạo muối kém bền của Mn+4 theo phản ứng trao đổi,mà tác dụng như chất oxi hóa.
3.2. Bản chất của HCl (Axit clohidric)
– Trong phản ứng trên HCl là chất khử.
– HCl là axit mạnh tác dụng được với oxit.
4. Điều chế Clo trong phòng thí nghiệm bằng cách nào?
Để điều chế Clo trong phòng thí nghiệm, người ta cho axit clohydric đặc tác dụng với một chất oxi hóa mạnh, có thể là mangan dioxit rắn hoặc kali penmanganat rắn,…Nếu dùng mangan dioxit thì cần xúc tác nhiệt độ còn với kali penmanganat thì có thể đun hoặc không đun nóng.
Vì khí clo thu được sau phản ứng thường bị lẫn tạp chất là khí hiđro clorua và hơi nước nên để điều chế khí nguyên chất, người thực hiện sẽ dẫn khí qua các bình rửa khí có chứa dung dịch NaCl để giữ lại HCl và chứa H2SO4 đặc để giữ hơi nước.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
Còn trong công nghiệp, khí Clo được điều chế bằng cách điện phân nóng chảy muối Natri clorua.
2NaCl → 2Na + Cl2
Hoặc điện phân dung dịch muối có màng ngăn, theo phương trình phản ứng như sau:
2NaCl + 2H2O → H2+ 2NaOH + Cl2
5. Tính chất hoá học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
5.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl–
5.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 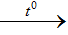 FeCl2 + H2
FeCl2 + H2
2Al + 6HCl 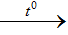 2AlCl3 + 3H2
2AlCl3 + 3H2
Cu + HCl → không có phản ứng
5.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 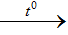 CuCl2 + H2 O
CuCl2 + H2 O
Fe2 O3 + 6HCl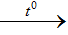 2FeCl3 + 3H2 O
2FeCl3 + 3H2 O
5.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 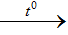 MnCl2 + Cl + 2H2 O
MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan (cường thuỷ) có khả năng hoà tan được Au (vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
6. Tính chất của MnO2
6.1 Tính chất vật lý
Một số tính chất vật lý cơ bản của MnO2:
– Là chất bột màu đen.
– Có thành phần không hợp phức.
– Khi được đun nóng nó phân hủy thành những oxit thấp hơn.
– Không tan trong nước.
6.2. Tính chất hóa học
Ở điều kiện thường, MnO2 là oxit bền nhất trong những oxit của mangan và tương đối trơ. Khi đun nóng, MnO2 tan được trong axit và kiềm như những oxit lưỡng tính. Chúng tác dụng với dung dịch axit đặc không tạo muối kém bền mà có vai trò như là chất oxi hóa.
– MnO2 tan trong dung dịch kiềm đặc tạo ra dung dịch màu xanh làm chứa những ion Mn +5 và Mn +3. Còn ion Mn +4 không sống sót được.
2M nO2 + 6KOH → K3MnO4 + K3 [Mn (OH)6].
– Khi nấu chảy với kiềm hay oxit bazơ mạnh tạo ra muối manganit.
MnO2 + 2NaOH → Na2MnO3 + H2OMnO2 + CaO → CaMnO3.
– Ở nhiệt độ cao, MnO2 hoàn toàn có thể bị khử bởi H2, CO và C thành sắt kẽm kim loại.
– Huyền phù của MnO2 trong nước ở 0°C tác dụng với khí SO2 tạo ra Mangan (II) đithionat (MnS2O6).
– Đun nóng huyền phù này với khí SO2 thì tạo muối mangan (II) sunfat:
MnO2 + SO2 → MnSO4.
– Khi nấu chảy với kiềm và có mặt của xúc tác KNO3, KClO3 hay O2 tạo ra Mangan Đioxit bị oxi hóa thành Manganate.
6.3. Ứng dụng
Pirolusit và Mangan Oxide tự tạo là hợp chất của Mn có nhiều tác dụng nhất trong thực tiễn. Ở dạng bột, MnO2 dùng làm chất xúc tác cho phản ứng phân hủy (KClO3; H2O2); phản ứng oxi hóa NH3 tạo NO; biến axit axetic thành axeton. Ngoài ra, nó còn dùng làm nguyên vật liệu nấu thủy tinh. Trong công nghiệp đồ gốm, MnO2 được dùng để tạo màu cho men. Là vật tư không thể thiếu của pin khô và là nguyên liệu sản xuất feromangan.
7. Bài tập vận dụng liên quan
Câu 1. Trong phòng thí nghiệm, để điều chế Clo người ta dùng MnO2 với vai trò là:
A. Chất xúc tác
B. Chất oxi hóa
C. Chất khử
D. Vừa là chất oxi hóa, vừa khử.
Lời giải:
Trong phòng thí nghiệm, để điều chế Clo người ta dùng MnO2 với vai trò là: Chất oxi hóa
Câu 2. Để điều chế Clo trong phòng thí nghiệm cần dùng các hóa chất
A. KMnO4 và NaCl.
B. MnO2 và dung dịch HCl đặc.
C. Điện phân nóng chảy NaCl.
D. Cho H2 tác dụng với Cl2 có ánh sáng.
Lời giải:
Nguyên tắc điều chế clo trong phòng thí nghiệm là cho HCl đặc tác dụng với các chất oxi hóa mạnh như KMnO4, KClO3, MnO2, CaOCl2, …
Do đó để điều chế clo trong phòng thí nghiệm, cần dùng các hóa chất MnO2 và dung dịch HCl đặc.
Phương trình hóa học: 4HCl đặc + MnO2 → MnCl2 + Cl2 ↑ + 2H2O
Câu 3. Nước clo có chứa những chất nào sau đây:
A. H2O, Cl2, HCl, HClO
B. HCl, HClO
C. Cl2, HCl, H2O
D. Cl2, HCl, HClO
Lời giải:
Phương trình hóa học phản ứng
Cl2+ H2O ⇄ HCl + HClO
Do phản ứng thuận nghịch nên thành phần của nước clo gồm Cl2, H2O, HCl và HClO (Cl2 tuy là khí nhưng vẫn tan một phần trong nước).
Câu 4. Để thu được khí Cl2 tinh khiết người ta sử dụng hóa chất nào sau đây:
A. H2SO4 đặc
B. Ca(OH)2
C. H2O
D. NaCl
Lời giải:
Để thu được khí Cl2 tinh khiết người ta sử dụng hóa chất H2SO4 đặc
Câu 5. Điều chế Clo từ HCl và MnO2. Cho toàn bộ khí Cl2 điều chế được qua dung dịch NaI, sau phản ứng thấy có 25,4 gam I2 sinh ra. Khối lượng HCl đã dùng là:
A. 9,1 gam
B. 14,6 gam
C. 7,3 gam
D. 12,5 gam
Lời giải:
nI2= 25,4254 = 0,1 mol
Theo phương trình hóa học:
Cl2 + 2NaI → 2NaCl + I2
=> nCl2 = nI2= 0,1 mol
Theo phương trình hóa học
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
=> nHCl = nCl2. 4 = 0,1.4 = 0,4 mol
=> mHCl = 0,4. 36,5 = 14,6 g
Câu 6. Hỗn hợp khí X gồm O2, Cl2, CO2, SO2. Để thu được O2 tinh khiết, người ta dẫn X qua:
A. nước brom
B. dung dịch KOH
C. dung dịch HCl
D. nước clo
Lời giải:
Để thu được O2 tinh khiết, người ta dẫn X qua dung dịch KOH vì Cl2, CO2 và SO2 đều có phản ứng
2KOH + Cl2→ KCl + KClO + H2O
CO2 + 2KOH → K2CO3 + H2O
SO2 + 2KOH → K2SO3 + H2O
Câu 7. Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. điện phân dung dịch NaCl có màng ngăn.
D. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Lời giải:
Câu 8. Cho 29,2 gam HCl tác dụng hết với KMnO4, thu được V lít khí Cl2 (đktc). Giá trị của V là
A. 8,96
B. 17,92
C. 5,60
D. 11,20
Lời giải:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
⇒ nHCl = 29,236,5 = 0,8 (mol) ⇒ nCl2 = 0,8.516 = 0,25
V = 0,25 . 22,4 = 5,6 (l)
Câu 9. Có các nhận xét sau về clo và hợp chất của clo:
1) Nước zaven có khả năng tẩy mầu và sát khuẩn.
2) Cho giấy quì tím vào dung dịch nước clo thì quì tím chuyển mầu hồng sau đó lại mất mầu.
3) Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
4) Trong công nghiệm Cl2 được điều chế bằng cách điện phân dung dịch NaCl (màng ngăn, điện cực trơ)
Trong các nhận xét trên, số nhận xét đúng là:
A. 2.
B. 3.
C. 4.
D. 1.
Lời giải:
Câu 10. Để phân biệt dung dịch NaCl với dung dịch NaNO3 người ta dùng dung dịch nào dưới đây:
A. Qùy tím
B. Phenolphtalein
C. AgNO3
D. BaCl2
Lời giải:
Câu 11. Trong phòng thí nghiệm, khí oxi được thu bằng phương pháp dời chỗ của nước. Phương pháp này dựa vào tính chất nào sau đây của oxi?
A. Tan tốt trong nước.
B. Ít tan trong nước.
C. Tính oxi hóa mạnh.
D. Nặng hơn không khí.
Lời giải:
Câu 12. Người ta thu khí oxi bằng cách đẩy không khí là dựa vào tính chất nào?
A. Oxi tan trong nước
B. Oxi nặng hơn không khí
C. Oxi không mùi, màu, vị
D. Khí oxi dễ trộn lẫn trong không khí
Lời giải:
Câu 13. Cho các nội dung nhận định về clo sau:
1) Nước Javen có khả năng tẩy màu và sát khuẩn.
2) Cho giấy quì tím vào dung dịch nước clo thì quì tím chuyển màu hồng sau đó lại mất màu.
3) Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
4)Trong công nghiệm Cl2 được điều chế bằng cách điện phân dung dịch NaCl (màng ngăn, điện cực trơ)
Trong các nhận định trên, số nhận xét đúng là:
A. 2.
B. 3.
C. 4.
D. 1.
Lời giải:
Có các nhận xét sau về clo và hợp chất của clo:
1) Đúng vì Tính chất sát trùng và tẩy màu của nước Gia-ven là do chất NaOCl, nguyên tử Cl có số oxi hóa là +1, thể hiện tính oxi hóa mạnh.
2) Đúng vì Khi cho mẩu quỳ tím ẩm vào bình đựng khí Cl2 có phản ứng:
Cl2+ H2O ↔ HCl + HClO. Phản ứng sinh ra hai axit làm quỳ tím chuyển sang màu đỏ. Tuy nhiên HClO có tính oxi hóa mạnh có thể phá hủy các hợp chất màu.
Vậy hiện tượng thu được là quỳ tím chuyển sang màu đỏ, sau đó mất màu.
3) Sai
4) Đúng
Trong công nghiệp người ta điều chế Cl2 bằng cách điện phân dung dịch NaCl có màng ngăn.
Mục đích của màng ngăn là để tránh Cl2 tiếp xúc phản ứng với dung dịch NaOH tạo nước Gia-ven.
Câu 14. Thực hiện các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH.
(b) Cho S tác dụng với H2SO4 đặc nóng
(c) Cho SO2 vào dung dịch KMnO4
(d) Cho SiO2 vào dung dịch HF.
Trong các thí nghiệm trên, số thí nghiệm có phản ứng oxi hóa – khử xảy ra là
A. 1
B. 2
C. 3
D. 4
Lời giải:
(a) Đúng
Cl2 + 2NaOH → NaCl + NaClO + H2O
(b) Đúng
(c) Đúng
5SO2 + 2KMnO4 + 2H2O → 2MnSO4+ K2SO4 + 2H2SO4
(d) Sai
SiO2 + 4HF → SiF4 + 2H2O
Câu 15. Cho 3,16 gam KMnO4 tác dụng với dung dịch HCl (dư), sau khi phản ứng xảy ra hoàn toàn thì số mol HCl bị oxi hoá là
A. 0,05
B. 0,1
C. 0,02
D. 0,16
Lời giải:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Ta có nKMnO4 = 0,02
HCl có 2 phần, 1 là tạo môi trường, 2 là bị oxi hóa,
Mn7+ + 5e → Mn2+
2Cl– → Cl2 + 2e
bảo toàn e, ta có: nCl– khử = 5nMn7+ = 5. 0,02 = 0,1 mol
=> Số mol HCl bị oxi hóa là 0,1 mol
Tổng số mol HCl tham gia phản ứng là 0,16 mol
Câu 16. Đốt cháy bột Al trong bình khí Cl2 dư, sau khi phản ứng xảy ra hoàn toàn khối lượng chất rắn trong bình tăng 4,26 g. Khối lượng Al đã phản ứng là
A. 2,16 g.
B. 1,62 g.
C. 1,08 g.
D. 3,24 g.
Lời giải:
Xem thêm các phương trình hóa học khác:
Cr + O2 → Cr2O3
F2 + H2O → HF + O2
Br2 + H2O ⇄ HBr + HBrO
Cl2 + H2O ⇄ HCl + HClO
Cl2 + NaBr → NaCl + Br2
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




