Phản ứng Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
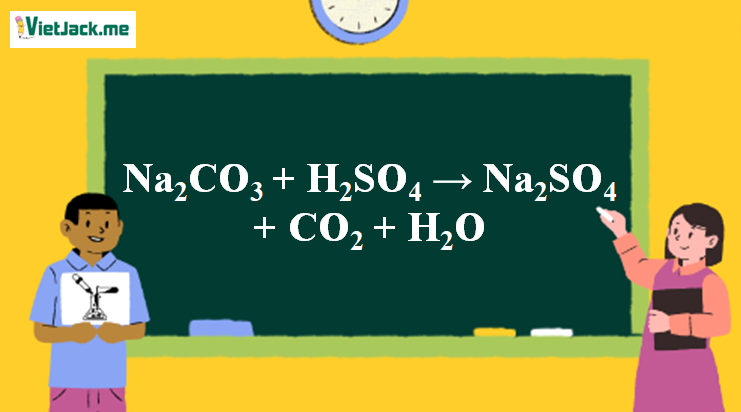
1. Phản ứng H2SO4 + Na2CO3
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
2. Điều kiện phản ứng giữa Na2CO3 và H2SO4
Ở nhiệt độ phòng
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Na2CO3 (Natri cacbonat)
Na2CO3 tác dụng với axit mạnh tạo muối mới và nước và đồng thời cũng giải phóng khí CO2.
3.2. Bản chất của H2SO4 (Axit sunfuric)
H2SO4 là một axit mạnh tác dụng được với muối.
4. Tính chất hoá học của H2SO4
4.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
4.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
5. Ứng dụng H2SO4
H2SO4 được sử dụng rộng rãi trong sản xuất kim loại như đồng, kẽm,… và dùng để làm sạch bề mặt thép và dung dịch tẩy gỉ.
Axit sunfuric còn được dùng để sản xuất nhôm sunfat (phèn làm giấy), các loại muối sunfat, chế tạo thuốc nổ, thuốc nhuộm, chất dẻo, tẩy rửa kim loại trước mạ, sản xuất dược phẩm.
Hỗn hợp H2SO4 với nước được dùng làm chất điện giải trong các dạng ắc quy, axit chì,…
Mỗi năm có khoảng 160 triệu tấn H2SO4 được sử dụng, nổ bật trong các ngành sản xuất như phân bón 30%, chất tẩy rửa 14%, giấy, sợi 8%, chất dẻo 5%, luyện kim 2%, phẩm nhuộm 2%, …
6. Tính chất hóa học của Na2CO3
Na2CO3 là chất lưỡng tính tác dụng được cả axit và bazơ, Na2CO3 là muối trung hòa tạo môi trường trung tính nên nó có tác dụng đầy đủ tính chất hóa học như sau.
Tác dụng với axit mạnh tạo thành muối và nước giải phóng khí CO2:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
Tác dụng với bazơ tạo muối mới và bazo mới:
Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3↓
Tác dụng với muối tạo hai muối mới:
Na2CO3 + CaCl2 → 2NaCl + CaCO3
Chuyển đổi qua lại với natri bicacbonat theo phản ứng:
Na2CO3 + CO2 + H2O ⇌ 2NaHCO3
Khi tan trong nước, Na2CO3 bị thủy phân:
Na2CO3 → 2Na+ + CO32−
CO32− + H2O ⇌ HCO3− + OH− ⇒ Dung dịch Na2CO3 có tính bazo yếu.
Na2CO3 bị thủy phân mạnh tạo môi trường bazơ, làm đổi màu các chất chỉ thị:
Chuyển dung dịch phenolphtalein không màu sang màu hồng.
Na2CO3 làm quỳ tím chuyển sang màu xanh.
7. Bài tập vận dụng
Câu 1. Trộn những cặp chất nào sau đây ta thu được NaCl?
A. Dung dich Na2CO3 và dung dịch BaCl2
B. Dung dịch NaNO3 và CaCl2.
C. Dung dịch KCl và dung dịch NaNO3
D. Dung dịch Na2SO4 và dung dịch KCl
Lời giải:
Đáp án: A
Câu 2. Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng:
A. Dung dịch AgNO3.
B. Dung dịch HCl.
C. Dung dịch BaCl2.
D. Dung dịch Pb(NO3)2.
Lời giải:
Đáp án: C
Câu 3. Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
C. Cả 2 muối đều bị thủy phân tạo mỗi trường kiềm yếu.
D. Cả 2 muối đều có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Lời giải:
Đáp án: A
Câu 4. Cho các chất sau : Na, Na2O, NaCl. NaHCO3, Na2CO3. Số chất có thể tạo ra NaOH trực tiếp từ một phản ứng là:
A. 2
B. 3
C. 4.
D. 5.
Lời giải:
Đáp án: D
Câu 5. Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,020.
B. 0,030.
C. 0,015.
D. 0,010.
Lời giải:
Đáp án: D
Giải thích:
Nhỏ từ từ HCl vào dung dịch thứ tự phản ứng:
H+ + CO32- → HCO3– (1)
H+ + HCO3– → CO2 + H2O (2)
nH+ = 0,03 mol
nCO32- = 0,02 mol < nH+
nH+ (2) = nCO2 = 0,03 – 0,02 = 0,01 mol
Xem thêm các phương trình phản ứng hóa học khác:
H2S + HNO3 → H2O + NO + S
H2O2 → O2 + H2O
ZnS + H2SO4 → ZnSO4 + H2S
P2O5 + H2O → H3PO4
P2O5 + KOH → K3PO4 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




