Phản ứng NH3 + Cl2 → N2 + NH4Cl
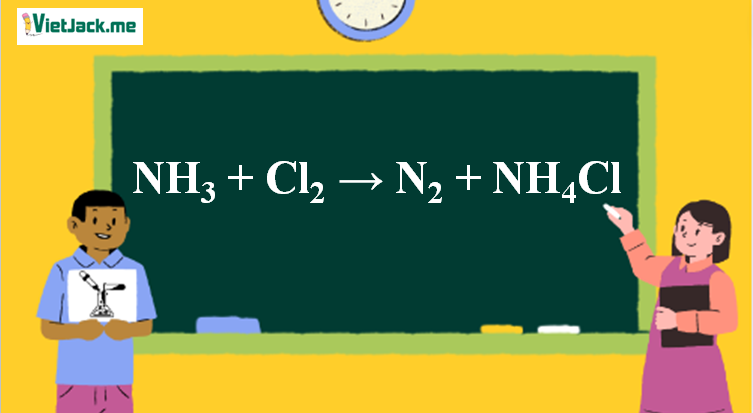
1. Phương trình NH3 tác dụng với Cl2
8NH3 + 3Cl2 → N2 + 6NH4Cl
2. Điều kiện phản ứng xảy ra giữa phản ứng NH3 và Cl2
Không có
3. NH3 + Cl2 có hiện tượng
Xuất hiện khói trắng amoni clorua (NH4Cl).
4. Tính chất hoá học của NH3
4.1. Tính bazơ yếu
– Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH–
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
– Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
– Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
4.2. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
4.3. Tính khử
– Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
– Tác dụng với oxi:
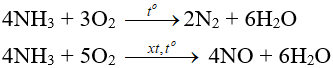
– Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
– Tác dụng với CuO:
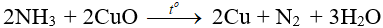
4.4. Điều chế
– Trong phòng thí nghiệm
2NH4Cl + Ca(OH)2 → NH3 + CaCl2 + H2O
– Trong công nghiệp
NH3 được cấu tạo từ azot và hydro liên kết với nhau. Azot được thu từ không khí còn hydro được tạo thành từ nước. Sau khi được sấy khô, hâm nóng và nén ở 530 o C, hỗn hợp này (azot, hydro) được cho qua các liên kết muối khác nhau để tạo thành amoniac.
5. Tính chất hóa học của Cl2
5.1. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất)
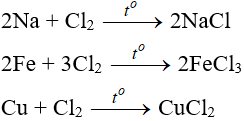
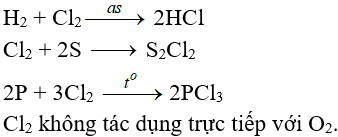
5.2. Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
5.3. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất oxi hóa, vừa là chất khử.
Tác dụng với nuớc:
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với dung dịch bazơ:
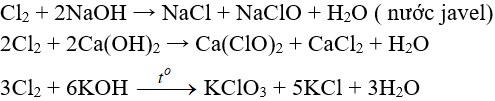
5.4. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
5.5. Tác dụng với chất khử khác
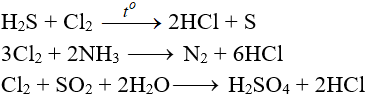
5.6. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
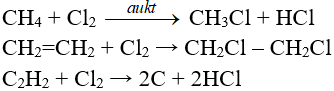
6. Bài tập vận dụng liên quan
Câu 1. Phản ứng của NH3 với Cl2 tạo ra “khói trắng” , chất này có công thức hoá học là :
A. HCl
B. N2
C. NH4Cl
D. NH3
Lời giải:
Câu 2. Muối được làm bột nở trong thực phẩm là
A. (NH4)2CO3.
B. NH4NO3.
C. NH4HSO3.
D. NH4Cl.
Lời giải:
Câu 4. Oxi hóa 3 lít NH3(tạo ra N2 và NO theo tỉ lệ mol 1 : 4) cần vừa đủ V là không khí ( chứa 20% oxi về thể tích). Các thể tích đó ở cùng điều kiện. Giá trị của V là
A. 16,25.
B. 22,5.
C. 32,5.
D. 24,5.
Lời giải:
12NH3 + 13O2 → 8NO + 2N2 + 18H2O
VO2 = 3.1312 = 3,25 mol
⇒ Vkk = 3,2520% = 16,25 lít
Câu 5. Chọn phát biểu đúng
A. Các muối amoni đều lưỡng tính
B. Các muối amoni đều thăng hoa
C. Urê cũng là muối amoni
D. Phản ứng nhiệt phân NH4NO3 là phản ứng tự oxi hóa, tự khử
Lời giải:
Câu 6. Cho các phát biểu sau:
1. Trong phân tử HNO3 nguyên tử N có hoá trị V, số oxi hoá +5
2. Để làm khô khí NH3 có lẫn hơi nước ta dẫn khí qua bình đựng vôi sống (CaO)
3. HNO3 tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm
4. NH3 thể hiện tính khử khi tác dụng với CuO
Số phát biểu đúng:
A. 1
B. 3
C. 4
D. 2
Lời giải:
(2) Để làm khô khí NH3 có lẫn hơi nước ta dẫn khí qua bình đựng vôi sống (CaO);
(3) HNO3 tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm;
(4) NH3 thể hiện tính khử khi tác dụng với CuO
Câu 7.Tìm phát biểu đúng
A. NH3 là chất Oxi hóa mạnh
B. NH3 có tính khử mạnh, tính Oxi hóa yếu
C. NH3 là chất khử mạnh
D. NH3 có tính Oxi hóa mạnh, tính khử yếu
Lời giải:
Câu 8. Hợp chất nào của nitơ không được tạo ra khi cho HNO3 tác dụng với kim loại:
A. NO
B. NH4NO3
C. NO2
D. N2O5
Lời giải:
Xem thêm các phương trình hóa học khác:
NH3 + O2 → NO + H2O
NH3 + HCl → NH4Cl
NH3 + H2O → NH4OH
NH3 + AlCl3 + H2O → Al(OH)3 + NH4Cl
NH4Cl + AgNO3 → NH4NO3 + AgCl
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




