Phương trình trạng thái của khí lí tưởng và cách giải các dạng bài tập chi tiết nhất
I. Lý thuyết
1. Khái niệm
– Khí lí tưởng là chất khí trong đó các phân tử được coi là các chất điểm và chỉ tương tác khi va chạm. Chỉ có khí lí tưởng là tuân theo đúng các định luật về chất khí đã học.
– Phương trình trạng thái khí lý tưởng là phương trình xác định mối liên hệ giữa ba thông số trạng thái (áp suất, thể tích, nhiệt độ) của chất khí.
2. Phương trình trạng thái của khí lí tưởng
Gọi p1, V1, T1 là áp suất, thể tích và nhiệt độ của lượng khí ở trạng thái 1. Thực hiện một quá trình bất kì chuyển khí sang trạng thái 2 có áp suất p2, thể tích V2 và nhiệt độ T2.
Mối liên hệ giữa các đại lượng đó là:
p1.V1T1=p2.V2T2
Việc chọn trạng thái 1, 2 là bất kì.
Do đó, ta có phương trình trạng thái của khí lí tưởng:
p.VT=hằng số
Trong đó:
+ p là áp suất (N/m2 hoặc Pa)
+ V là thể tích (m3)
+ T là nhiệt độ tuyệt đối (K)
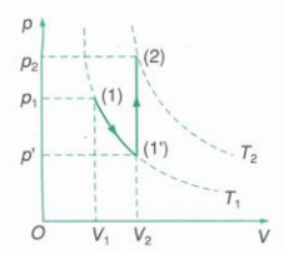
Đồ thị biểu diễn quá trình biến đổi trạng thái trong hệ tọa độ (p,V)
Chuyển lượng khí từ trạng thái 1 (p1, V1, T1) sang trạng thái 2 (p2, V2, T2) qua trạng thái trung gian 1’ (p’, V2, T1) bằng các đẳng quá trình.
3. Kiến thức mở rộng
– Từ công thức trên, ta có thể tính:
+ Nhiệt độ tuyệt đối của lượng khí ở trạng thái 1 là : T1=p1.V1T2p2.V2
+ Áp suất của lượng khí ở trạng thái 1 là : p1=p2T1V2V1.T2
+ Thể tích của lượng khí ở trạng thái 1 là : V1=p2T1V2p1T2
+ Nhiệt độ tuyệt đối của lượng khí ở trạng thái 2 là : T2=p2.V2T1p1.V1
+ Áp suất của lượng khí ở trạng thái 2 là : p2=p1T2V1V2.T1
+ Thể tích của lượng khí ở trạng thái 2 là : V2=p1T2V1p2T1
– Đổi đơn vị nhiệt độ:
K = 0C + 273
⁰F = 1,8 . ⁰C + 32
– Công thức khối lượng riêng:
D=mV⇒m=D.V⇒V=mD
Trong đó: D là khối lượng riêng (kg/m3)
m là khối lượng (kg)
V là thể tích (m3)
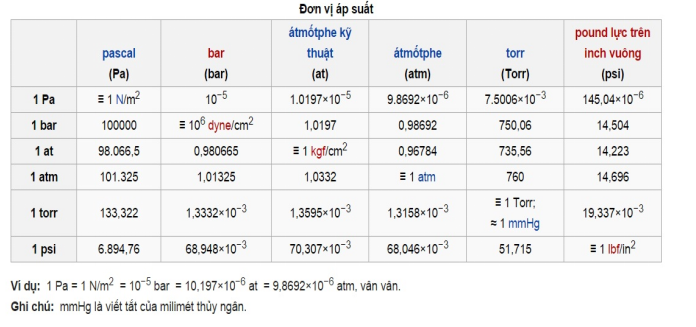
– Bảng chuyển đổi đơn vị áp suất:
– Ở điều kiện tiêu chuẩn, trạng thái của một lượng khí:
+ Áp suất: 1 atm
+ Nhiệt độ: 00C
+ Thể tích: 22,4 lít
Chú ý: Do sự khác biệt giữa khí thực và khí lí tưởng không lớn ở những nhiệt độ và áp suất thông thường. Nên trong đời sống và kĩ thuật, khi không yêu cầu độ chính xác cao, ta có thể áp dụng các định luật về chất khí lí tưởng để tính áp suất, thể tích và nhiệt độ của khí thực.
II. Bài tập vận dụng
Bài 1:Trong xi lanh của một động cơ đốt trong có 2 lít hỗn hợp khí áp dưới áp suất 1,5 atm và nhiệt độ 27°C. Pittông nén xuống làm cho thể tích của hỗn hợp khí chỉ còn bằng 0,3 lít và áp suất tăng lên tới 18 atm. Tính nhiệt độ của hỗn hợp khí nén.
Lời giải
– Trạng thái 1: V1=2lp1=1,5atmT1=27+273=300K- Trạng thái 2 : V2=0,3lp2=18atmT2=?
Áp dụng phương trình trạng thái của khí lí tưởng:
p1V1T1.p2.V2T2⇒T2=p2V2T1p1V1=18.0,3.3001,5.2=540KMà T2=273+t2⇒t2=267°C
Bài 2: Trong một khu hội chợ người ta bơm một quả bóng có thể tích 200 lít ở nhiệt độ 27°C trên mặt đất. Sau đó bóng được thả bay lên đến độ cao mà ở đó áp suất khí quyển chỉ còn 0,8 lần áp suất khí quyển ở mặt đất và có nhiệt độ 17°C. Tính thể tích của quả bóng ở độ cao đó, bỏ qua áp suất phụ gây ra bởi vỏ bóng.
Lời giải
– Trạng thái 1: V1=200lp1T1=27+273=300K- Trạng thái 2 : V2=?p2=0,8.p1T2=273+17=290K
Áp dụng phương trình trạng thái của khí lí tưởng:
V2=p1T2V1p2T1=p1.200.2900,8.p1.300=241,67(l)
Bài 3: Một lượng khí đựng trong một xi lanh có pittông chuyển động được. Các thông số trạng thái của lượng khí này là: 2 atm, 300K. Khi pit tong nén khí, áp suất của khí tăng lên tới 3,5 atm, thể tích giảm còn 12l. Xác định nhiệt độ của khí nén.
Lời giải
T2=p2.V2T1p1.V1=420K
Bài 4: Một bóng thám không được chế tạo để có thể tăng bán kính lên tới 10m khi bay ở tầng khí quyển có áp suất 0,03atm và nhiệt độ 200K. Hỏi bán kímh của bóng khi bơm, biêt bóng được bơm khí ở áp suất 1 atm và nhiệt độ 300K ?
Lời giải
V1=p2T1V2p1T2⇒43πR13=0,03.43π.103.300200.1⇒R1≈3,56m
Bài 5: Tính khối lượng riêng của không khí ở nhiệt độ 100°C và áp suất 2.105Pa. Biết khối lượng riêng của không khí ở 0°C và 1,01.105 Pa là 1,29kg/m3.
Lời giải
Thể tích của 1 kg không khí ở điều kiện chuẩn là:
V0=mρ0=11,29=0,78m3
Ở 0°C và 101 kPa: po = 101 kPa
V0 = 0,78 m3
T0 = 273 K
Ở 100°C và 200 kPa: p = 200 kPa
T = 373 K
V = ?
Ta có:
p0V0T0=pVT⇒V=0,54m3Và ρ=10,54=1,85kg/m3
Bài 6: Một bình cầu dung dịch 20l chứa oxi ở nhiệt độ 16°C và áp suất 100atm. Tính thể tích của lượng khí này ở điều kiện chuẩn. Tạo sao kết quả tìm được chỉ là gần đúng?
Lời giải:
V0 = 1889 lít.
Vì áp suất quá lớn nên khí không thể coi là khí lí tưởng. Do đó kết quả tìm được chỉ mang tính gần đúng
Bài 7: Người ta bơm khí oxi ở điều kiện chuẩn vào một bình có thể tích 5000l. sau nữa giờ bình chứa đầy khí ở nhiệt độ 24°C và áp suất 765mmHg. Xác định khối lượng khí bơm vào sau mỗi giây. Coi quá trình bơm diễn ra một cách điều đặn.
Lời giải:
Lượng khí bơm vào trong mỗi giây: 3,3g.
Sau t giây khối lượng khí trong bình là:
m=ρ∆Vt=ρV
Với ρ là khối lượng riêng của khí.
ΔV là thể tích khí bơm vào sau mỗi giây.
V là thể tích khí bơm vào sau t giây.
pVT=P0V0T0(1) với V=mρvà V0=mρ0
thay V và V0 vào (1) ta được: ρ=p.T0ρ0p0T
Lượng khí bơm vào sau mỗi giây là:
x=mt=Vρt=Vt.p.T0ρ0p0T=5.765.273.1,291800.760.297=0,0033kg/s=3,3g/s
Bài 8: Một phòng có kích thước 8m x 5m x 4m. Ban đầu không khí trong phòng ở điều kiện chuẩn, sau đó nhiệt độ của không khí tăng lên tới 10°C, trong khi áp suất là 78 cmHg. Tính thể tích của lượng khí đã ra khỏi phòng và khối lượng không khí còn lại trong phòng.
Lời giải:
ΔV = 1,6m3 ; m’ = 204,84 kg
Lượng không khí trong phòng ở trạng thái ban đầu (điều kiện chuẩn)
p0 = 76 cmHg ; V0 = 5.8.4 = 160 m3 ; T0 = 273 K
Lượng không khí trong phòng ở trạng thái 2:
p2 = 78 cmHg ; V2 ; T2 = 283 K
Ta có:
p0V0T0=p2.V2T2⇒V2=p0V0T2T0p2=76.160.283173.78≈161,60m3
Thể tích không khí thoát ra khỏi phòng:
ΔV =V2 – V0 = 161,6 – 160 = 1,6 m3
Thể tích không khí thoát ra khỏi phòng tính ở điều kiện chuẩn là:
p0∆V0T0=p2.∆VT2⇒∆V0=p2.∆V0T0T2p0=1,6.78.273283.76≈1,58m3
Khối lượng không khí còn lại trong phòng:
m’=m-∆m=Voρ0-∆V0ρ0=ρ0(V0-∆V0)m’≈204,84kg
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.





