Phản ứng Cr + O2 → Cr2O3
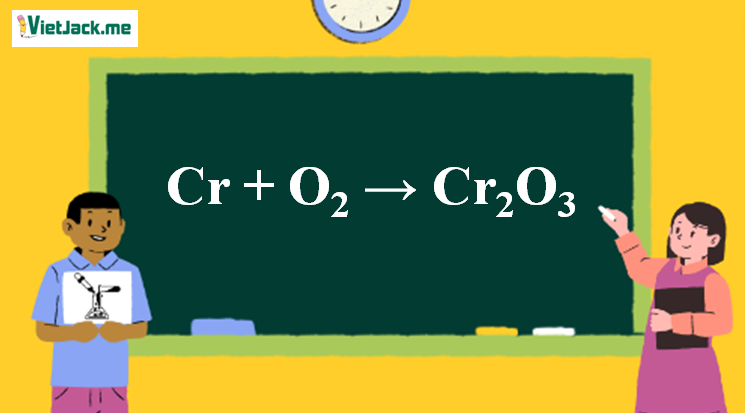
1. Phương trình phản ứng giữa Cr và O2
4Cr + 3O2 2Cr2O3
2. Điều kiện phản ứng xảy ra
Nhiệt độ cao
Ở nhiệt độ thường, crom chỉ tác dụng với Flo. Ở nhiệt độ cao, crom tác dụng với oxi, clo, lưu huỳnh.
3. Bản chất của Cr (Crom) trong phản ứng
Cr là kim loại có tính khử mạnh tác dụng được với các phi kim như O2, Cl2,…
4. Tính chất của Cr
4.1. Tính chất vật lí
– Crom là kim loại màu trắng bạc, có khối lượng riêng lớn (d = 7,2 g/cm3), tonc = 1890oC.
– Là kim loại cứng nhất, có thể rạch được thuỷ tinh.
4.2. Tính chất hóa học
– Là kim loại có tính khử mạnh hơn sắt.
– Trong các hợp chất crom có số oxi hoá từ +1 → +6 (hay gặp +2, +3 và +6).
a. Tác dụng với phi kim
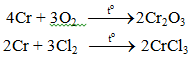
b. Tác dụng với nước
Cr bền với nước và không khí do có lớp màng oxit rất mỏng, bền bảo vệ. Người ta mạ crom lên sắt để bảo vệ sắt và dùng Cr để chế tạo thép không gỉ.
c. Tác dụng với axit
Cr + 2HCl → CrCl2 + H2
Cr + H2SO4 → CrSO4 + H2
Cr không tác dụng với dung dịch HNO3 hoặc H2SO4 đặc, nguội.
4.3. Điều chế Cr
– Cr2O3 được tách ra từ quặng, sau đó điều chế crom bằng phương pháp nhiệt nhôm:
C2O3 + 2Al → 2Cr + Al2O3
5. Tính chất hóa học của O2
– Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
– Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
– Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, …) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
5.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
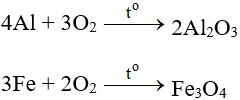
5.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
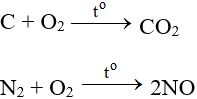
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
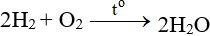
5.3. Tác dụng với hợp chất
– Tác dụng với các chất có tính khử:
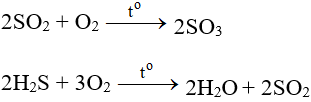
– Tác dụng với các chất hữu cơ:
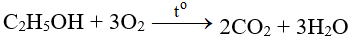
6. Bài tập vận dụng liên quan
Câu 1. Chất nào saụ đây không có tính lưỡng tính ?
A. Cr(OH)2
B. Cr2O3
C. Cr(OH)3
D. Al2O3
Lời giải:
Câu 2. Chọn phát biểu đúng về phản ứng của crom với phi kim.
A. Ở nhiệt độ thường crom chỉ phản ứng với flo.
B. Ở nhiệt độ cao, oxi sẽ oxi hoá crom thành Cr(VI).
C. Lưu huỳnh không phán ứng được với crom.
D. Ở nhiệt độ cao, clo sẽ oxi hoá crom thành Cr(II).
Lời giải:
Câu 3. Các số oxi hóa đặc trưng của crom là
A. +2, +4 và +6.
B. +2, +3 và +6.
C. +1, +3 và +6.
D. +3, +4 và +6.
Lời giải:
Câu 4. Ứng dụng không hợp lí của crom là
A. Crom là kim loại rất cứng có thể dùng để cắt thủy tinh.
B. Crom dùng để tạo thép cứng, không gỉ, chịu nhiệt.
C. Crom là kim loại nhẹ, được sử dụng tạo các hợp kim của ngành hàng không.
D. Điều kiện thường, crom tạo lớp màng oxit mịn, bền được dùng để mạ bảo vệ thép.
Lời giải:
Câu 5. Các kim loại nào sau đây luôn được bảo vệ trong môi trường không khí, nước nhờ lớp màng oxit?
A. Al và Ca
B. Fe và Cr
C. Cr và Al
D. Fe và Al
Lời giải:
Xem thêm các phương trình hóa học khác:
F2 + H2O → HF + O2
Br2 + H2O ⇄ HBr + HBrO
Cl2 + H2O ⇄ HCl + HClO
Cl2 + NaBr → NaCl + Br2
Cl2 + NaOH → NaCl + NaClO + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




