Phản ứng Br2 + H2O ⇄ HBr + HBrO
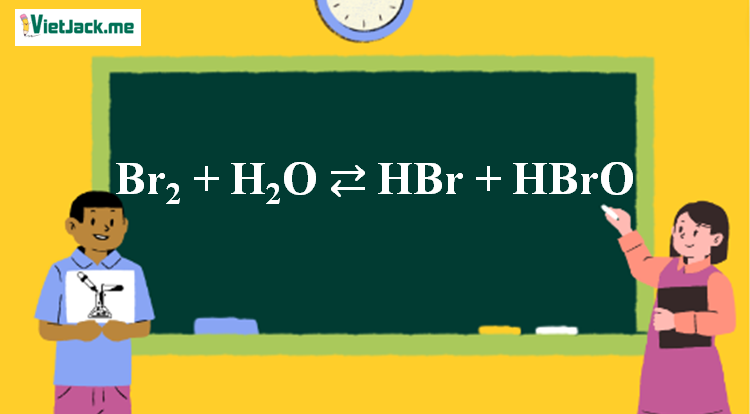
1. Brom tác dụng với nước
Br2 + H2O ⇄ HBr + HBrO
2. Điều kiện phản ứng Brom tác dụng với nước
Nhiệt độ thường
3. Hiện tượng phản ứng giữa Br2 và H2O
Brom tác dụng với nước rất chậm tạo ra axit bromhiđric HBr và Axit Hipobromơ HBrO. Dung dịch Brom (Br2) bị mất màu da cam.
4. Tính chất hóa học của Brom
Brom là một chất oxi hóa mạnh nhưng kém so với clo.
4.1. Tác dụng với kim loại
Brom tác dụng trực tiếp với nhiều kim loại và các phản ứng đều toả ra lượng nhiệt lớn.
Nhiệt độ thường:
3Br2 + 2Al → 2AlBr3
Khi đun nóng, Brom tác dụng với Hydro và phản ứng tỏa nhiều nhiệt nhưng không gây nổ:
Br2 + H2 → 2HBr
4.2. Tác dụng với hidro
Brom oxi hóa được hidro tạo ra bromua khi được đun nóng ở nhiệt độ cao
Br2+ H2 → 2HBr
4.3. Tác dụng với nước
Khi tan trong nược, một phần brom phản ứng rất chậm với nước tạo ra axit HBr và axit HBrO theo phản ứng thuận nghịch
Br2 + H2O ⇔ HBr + HBrO
4.4. Ứng dụng của Brom
– Được sử dụng như một chất chống cháy.
– Nó cũng được sử dụng trong nông nghiệp.
– Dùng làm phụ gia xăng dầu.
– Một công dụng khác có thể ít được biết đến của Brom là dùng để khử trùng bể bơi mái che.
– Được sử dụng trong dược phẩm, sản xuất thuốc nhuộm, mực in và làm thuốc hiện hình trong nghề ảnh.
5. Tính chất hóa học của H2O
5.1. Nước tác dụng với kim loại
Ở điều kiện thường, nước có thể phản ứng với các kim loại mạnh như Li, Ca, Na, K, Ba,… để tạo thành dung dịch Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một số kim loại trung bình như Mg, Zn, Al, Fe,…phản ứng được với hơi nước ở nhiệt độ cao tạo ra oxit kim loại và hidro. Bên cạnh đó, kim loại Mg tan rất chậm trong nước nóng.
5.2. Nước tác dụng với oxit bazo
Nước tác dụng với một số oxit bazo như Na2O, CaO , K2O,… tạo thành dung dịch bazo tương ứng. Dung dịch bazo làm cho quỳ tím hóa xanh.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
5.3. Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
6. Câu hỏi vận dụng liên quan
Câu 1. Nhận xét nào sau đây là đúng về tính oxi hóa của?
A. Tính oxi hóa của Brom mạnh hơn Flo nhưng yếu hơn Clo.
B. Tính oxi hóa của Brom mạnh hơn Clo nhưng yếu hơn Iot.
C. Tính oxi hóa của Brom mạnh hơn Iot nhưng yếu hơn Clo.
D. Tính oxi hóa của Brom mạnh hơn Flo nhưng yếu hơn Iot.
Lời giải:
Câu 2. Brom bị lẫn tạp chất là clo. Cách nào sau đây có thể thu được brom tinh khiết?
A. Dẫn hỗn hợp khí đi qua dung dịch NaOH
B. Dẫn hỗn hợp khí đi qua dung dịch nước
C. Dẫn hỗn hợp khí đi qua dung dịch NaBr
D. Dẫn hỗn hợp khí đi qua dung dịch NaI
Lời giải:
Câu 3. Nhận biết khí SO2 ta dùng dung dịch nước brom dư hiện tượng xảy ra là:
A. Dung dịch brom mất màu
B. Dung dịch Brom chuyển sang màu da cam
C. Dung dịch brom chuyển sang màu xanh
D. Không có hiện tượng
Lời giải:
Xem thêm các phương trình hóa học khác:
Cl2 + H2O ⇄ HCl + HClO
Cl2 + NaBr → NaCl + Br2
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + Ca(OH)2 → Ca(OCl)2 + CaCl2 + H2O
Cl2 + KOH đặc nóng → KCl + KClO3 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




