Phản ứng K2O + HBr → KBr + H2O
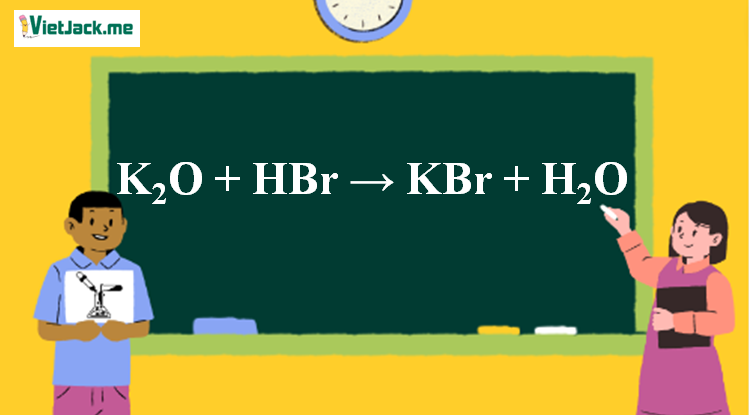
1. Phản ứng hóa học
K2O + 2HBr → 2KBr + H2O
2. Điều kiện phản ứng
Phản ứng xảy ra ở điều kiện thường.
3. Cách thực hiện phản ứng
Cho K2O phản ứng với dung dịch axit HBr.
4. Hiện tượng nhận biết phản ứng
K2O ( màu vàng nhạt) tan dần, sau phản ứng thu được dung dịch không màu.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K2O (Kali oxit)
K2O là oxit bazo phản ứng được với các axit thu được muối và nước.
5.2. Bản chất của HBr (Axit bromhidric)
HBr là một axit mạnh tác dụng với oxit bazo tạo thành muối và nước.
6. Tính chất hoá học của K2O
K2O là oxit bazo do đó mang đầy đủ tính chất hóa học của một oxit bazơ.
6.1. K2O tác dụng với nước
K2O tác dụng với nước tạo ra dung dịch kiềm KOH.
K2O + H2O → KOH
6.2. K2O tác dụng với oxit axit tạo thành muối
K2O + CO2→ K2CO3
6.3. K2O tác dụng với dung dịch axit
K2O + axit → muối + H2O
K2O + HCl → KCl + H2O
7. Tính chất vât lý của K2O
K2O là một chất bột màu trắng, không mùi, và có nhiệt độ nóng chảy khoảng 891°C
8. Tính chất hóa học của HBr
HBr thể hiện tính chất đặc trưng của 1 axit, bao gồm:
– Đổi màu chất chỉ thị: Khi nhỏ 1 ít dung dịch HBr vào chất chỉ thị màu, quỳ tím sẽ chuyển sang màu đỏ.
– Tác dụng với kim loại: Tạo ra muối bromide và giải phóng khí H2.
Chú ý: Không tác dụng được với những kim loại đứng sau nguyên tử H trong dãy hoạt động hoá học kim loại.
2HBr + 2Na → 2NaBr + H2
– Tác dụng với oxit bazơ: Tạo ra muối bromide và nước.
Na2O + 2HBr → 2NaBr + H2O
– Tác dụng với bazơ (Phản ứng trung hoà): Sản phẩm tạo thành là muối và nước
Mg(OH)2 + 2HBr → MgBr2+ 2H2O
– Tác dụng với muối: Sản phẩm tạo thành muối và axit. Để điều kiện phản ứng xảy ra cần thoả mãn điều kiện sau:
+ Muối tham gia vào quá trình phản ứng phải tan được trong nước.
+ Sản phẩm tạo thành phải là muối kết tủa hoặc axit yếu.
K2CO3 + 2HBr → 2KBr + H2O + CO2
AgNO3 + HBr → AgBr(kết tủa) + HNO3
– Tác dụng với nguyên tố phi kim:
Cl2 + 2HBr→ Br2 + 2HCl
9. Câu hỏi vận dụng
Câu 1. Cho m gam K2O phản ứng vừa đủ với 100ml dung dịch HBr 1M. Giá trị của m là
A. 9,4. B. 4,7. C. 4,9. D. 7,4.
Lời giải:
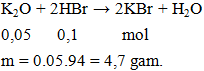
Đáp án B.
Câu 2. Chất nào sau đây không tác dụng với HBr?
A. Na. B. K2O. C. K. D. Cu.
Lời giải:
Cu không tác dụng với HBr.
Đáp án D.
Câu 3. Cho 9,4 gam K2O tác dụng với một lượng vừa đủ dung dịch HBr, thu được dung dịch X. Khối lượng chất tan có trong dung dịch X là
A. 23,8 gam. B. 14,9 gam. C. 10 gam. D. 19,4 gam.
Lời giải:
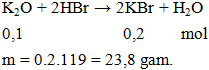
Đáp án A.
Xem thêm các phương trình hóa học khác:
K2O + HI → KI + H2O
KOH + CO2 → KHCO3
KOH + SO2 → KHSO3
KOH + HNO3 → KNO3 + H2O
KOH + CuSO4 → K2SO4+ Cu(OH)2
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




