Mời các bạn học sinh cùng tham khảo Đề thi Hóa học 12 Giữa kì 2 do trang Giải Bài Tập tổng hợp. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện để đạt điểm cao trong bài thi Hóa học 12.
NỘI DUNG
Sở Giáo dục và Đào tạo …..
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
ĐỀ BÀI
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133, Be = 9, Mg = 24, Ca = 40, Sr = 88, Ba = 137.
I. Phần trắc nghiệm
Câu 1: Khử hoàn toàn hỗn hợp gồm: CuO, FeO, MgO, PbO bằng khí CO. Chất rắn thu được sau phản ứng là
A. Cu, FeO, MgO, PbO.
B. Cu, Fe, MgO, PbO.
C. Cu, Fe, MgO, Pb.
D. Cu, Fe, Mg, PbO.
Câu 2: Chất nào sau đây được ứng dụng làm bột nở trong công nghiệp thực phẩm?
A. KNO3.
B. NaHCO3.
C. NaOH.
D. CaSO4.
Câu 3: Trong công nghiệp, Na được điều chế bằng cách nào dưới đây?
A. Điện phân nóng chảy Na2CO3.
B. Điện phân dung dịch NaCl có màng ngăn.
C. Khử NaCl bằng K.
D. Điện phân nóng chảy NaCl.
Câu 4: Chất nào sau đây có thể làm mềm nước cứng có tính vĩnh cửu?
A. NaCl.
B. H2SO4.
C. Na2CO3.
D. HCl.
Câu 5: Cho 6 gam hỗn hợp gồm Na và kim loại kiềm M tác dụng hết với nước được dung dịch X. Để trung hòa hết X cần 1,8 lít HCl 0,25M. Kim loại M là
A. Li.
B. K.
C. Rb.
D. Cs.
Câu 6: Bằng phương pháp hóa học, để phân biệt các dung dịch riêng biệt: K2SO4, MgCl2, AlCl3, có thể chỉ dùng một dung dịch là
A. AgNO3.
B. BaCl2.
C. KOH.
D. HNO3.
Câu 7: Cho H2 dư đi từ từ qua hỗn hợp X gồm: 16 gam Fe2O3 và 8 gam MgO nung nóng đến phản ứng hoàn toàn thu được a gam chất rắn Y. Giá trị của a là
A. 16.
B. 11,2.
C. 19,2.
D. 20,8.
Câu 8: Cho 0,2 gam một kim loại thuộc nhóm IIA tác dụng hết với dung dịch HCl thấy tạo ra 0,555 gam muối. Kim loại đó là
A. Be.
B. Mg.
C. Ba.
D. Ca.
Câu 9: Phát biểu nào sau đây là sai ?
A. Điều kiện để một kim loai A đẩy kim loại B ra khỏi muối là A phải mạnh hơn B.
B. Nguyên tử kim loại chỉ có tính khử, không có tính oxi hóa.
C. Kim loại có độ cứng lớn nhất là Cr.
D. Trạng thái cơ bản, kim loại kiềm thổ có số electron hóa trị là 2.
Câu 10: Điện phân nóng chảy muối clorua của kim loại M. Ở catot thu được 3 gam kim loại và ở anot có 1,68 lít khí ở đktc thoát ra. Muối clorua đó là
A. NaCl.
B. KCl.
C. BaCl2.
D. CaCl2.
II. Phần tự luận
Câu 1 (2 điểm): Không dùng chỉ thị, hãy phân biệt các dung dịch sau chứa trong lọ mất nhãn: KCl, BaCl2, Na2CO3.
Câu 2 (2 điểm): Cho 6,08 gam hỗn hợp X gồm 2 hiđroxit của 2 kim loại kiềm tác dụng hết với dung dịch HCl dư thấy tạo ra 8,30 gam hỗn hợp muối clorua. Biết 2 kim loại kiềm thuộc 2 chu kì liên tiếp trong BTH, tính % số mol mỗi hiđroxit trong hỗn hợp ban đầu.
Câu 3 (2 điểm): Dẫn V lít CO2 (đktc) vào dung dịch Ca(OH)3 thu được 25 gam kết tủa và dung dịch X, đun nóng dung dịch lại thu thêm được 5 gam kết tủa nữa. Tính giá trị của V.
Câu 4 (1 điểm): Sau phản ứng nhiệt nhôm của hỗn hợp X gồm bột Al với FexOy thu được 9,39 gam chất rắn Y. Cho toàn bộ Y tác dụng với dung dịch NaOH dư thấy có 336 ml khí (đktc) bay ra và phần không tan Z. Để hòa tan 1/3 lượng chất Z cần 12,4 ml dung dịch HNO3 65,3% (d = 1,4 g/ml) và thấy có khí màu nâu đỏ bay ra. Xác định công thức của FexOy.
ĐÁP ÁN CHI TIẾT
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | C | B | D | C | A | C | C | D | A | D |
Câu 1: Chất rắn thu được sau phản ứng là Cu, Fe, MgO, Pb. Chọn đáp án C.
Câu 2: NaHCO3 được ứng dụng làm bột nở trong công nghiệp thực phẩm. Chọn đáp án B.
Câu 3: Trong công nghiệp, Na được điều chế bằng cách điện phân nóng chảy NaCl. Chọn đáp án D.
Câu 4: Na2CO3 có thể làm mềm nước cứng có tính vĩnh cửu. Chọn đáp án C.
Câu 5: Đặt 2 kim loại tương ứng với 1 kim loại là X.
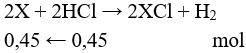
MX = 6 : 0,45 = 13,33. Vậy M là Li. Chọn đáp án A.
Câu 6: Dùng dung dịch KOH.
+ Xuất hiện kết tủa trắng → MgCl2.
+ Xuất hiện kết tủa keo trắng, tan trong KOH dư → AlCl3.
+ Không hiện tượng: K2SO4. Chọn đáp án C.
Câu 7: 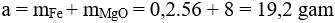
Câu 8:
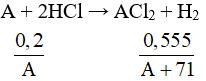
Ta có 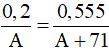
Câu 9: Phát biểu sai: “Điều kiện để một kim loai A đẩy kim loại B ra khỏi muối là A phải mạnh hơn B”. Chọn đáp án A.
Câu 10:
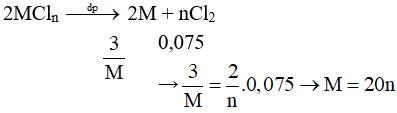
Vậy n = 2, M = 40 thỏa mãn. Muối là CaCl2. Chọn đáp án D.
2. Phần tự luận
Câu 1 (2điểm):
Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Nhỏ HCl vào từng mẫu thử, mẫu thử nào có khí thoát ra là Na2CO3, không hiện tượng là KCl và BaCl2 (nhóm I)
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
Dùng Na2CO3 vừa nhận ra cho vào hai mẫu thử nhóm I, mẫu thử nào có kết tủa trắng là BaCl2, không hiện tượng là KCl.
Na2CO3 + BaCl2 → BaCO3 ↓ + 2NaCl.
Câu 2 (2điểm):
Giả sử 2 kim loại là A và B (MA < MB), đặt 2 kim loại tương ứng với 1 KL là R → MA < MR < MB.
PTHH:
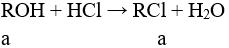
Sử dụng PP tăng giảm khối lượng: a = (8,3 – 6,08) : 18,5 = 0,12 mol
MROH = 6,08 : 0,12 = 50,67 → R = 33,67.
Vậy 2 hiđroxit là NaOH (x mol) và KOH (y mol)
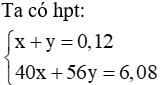
Giải hệ được: x = 0,04 và y = 0,08
→ %nNaOH = 33,33%; %nKOH = 66,67%.
Câu 3 (2điểm): Theo bài ra ta có các PTHH:

→ nCO2 = 0,35 mol
→ V = 7,84 lít.
Câu 4 (1điểm):

Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung học tập, giải trí và các kiến thức thú vị khác tại đây.