Phản ứng Cu + AgNO3 → Cu(NO3)2 + Ag
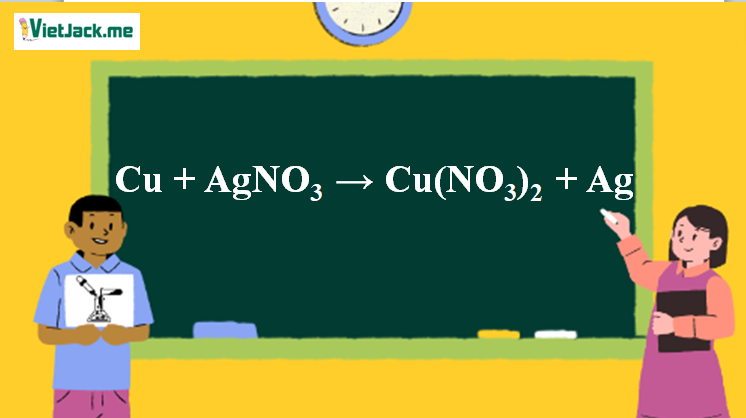
1. Phương trình phản ứng cho Cu tác dụng AgNO3
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
2. Cách tiến hành thí nghiệm đồng tác dụng bạc nitrat
Ngâm 1 đoạn dây đồng trong dung dịch Bạc nitrat.
3. Hiện tượng phản ứng Cu tác dụng AgNO3
Có kim loại màu xám ngoài dây đồng. Dung dịch ban đầu không màu chuyển dần sang màu xanh.
4. Điều kiện phản ứng kim loại tác dụng với muối xảy ra
Kim loại tham gia phản ứng phải mạnh hơn kim loại trong muối thì mới có thể đẩy kim loại đó ra khỏi dung dịch muối.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Cu (Đồng)
Cu là kim loại khử được các ion kim loại đứng sau nó và trong dung dịch muối.
5.2. Bản chất của AgNO3 (Bạc nitrat)
AgNO3 mang tính chất hoá học của muối tác dụng được với kim loại với điều kiện kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi muối.
6. Tính chất hoá học của Cu
Là kim loại kém hoạt động, có tính khử yếu.
6.1. Tác dụng với phi kim
– Cu phản ứng với oxi khi đun nóng tạo CuO bảo vệ nên Cu không bị oxi hoá tiếp tục.
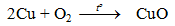
– Khi tiếp tục đun nóng tới (800-1000oC)
– Tác dụng với Cl2, Br2, S…
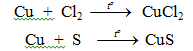
6.2. Tác dụng với axit
– Cu không tác dụng với dung dịch HCl, H2SO4 loãng.
– Khi có mặt oxi, Cu tác dụng với dung dịch HCl, nơi tiếp xúc giữa dung dịch axit với không khí.
2Cu + 4HCl + O2 → 2CuCl2 + 2 H2O
– Với HNO3, H2SO4 đặc :
Cu + 2H2SO4 đ → CuSO4 + SO2 + H2O
Cu + 4HNO3 đ → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
6.3. Tác dụng với dung dịch muối
– Khử được ion kim loại đứng sau nó trong dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
6.4. Điều chế
– Hầu hết quặng thương mại là các loại đồng sulfua, đặc biệt là chalcopyrit (CuFeS2) và ít hơn là chalcocit (Cu2S). Các khoáng này được tách ra từ các quặng được nghiền để nâng hàm lượng lên 10–15% đồng bằng froth flotation hay bioleaching. Nung vật liệu này với silica trong flash smelting để loại sắt ở dạng xỉ. Quá trình này khai thác dễ dàng chuyển sắt sulfua thành dạng ôxit của nó, sau đó các ôxit này phản ứng với silica để tạo ra xỉ silicat nổi lên trên khối nóng chảy. Sản phẩm tạo ra copper matte chứa Cu2S sau đó được roasted để chuyển tất cả các sulfua thành ôxit.
2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
– Ôxit đồng được chuyển thành đồng blister theo phản ứng nung
2 Cu2O → 4 Cu + O2
7. Mở rộng kiến thức về AgNO3
7.1. Tính chất vật lí & nhận biết
– Tính chất vật lí: Là chất rắn, có màu trắng, tan tốt trong nước, có nhiệt độ nóng chảy là 212oC.
– Nhận biết: Sử dụng muối NaCl, thu được kết tủa trắng
AgNO3 + NaCl →AgCl↓+ NaNO3
7.2. Tính chất hóa học
– Mang tính chất hóa học của muối
Tác dụng với muối
AgNO3 + NaCl →AgCl↓+ NaNO3
2AgNO3 + BaCl2 →2AgCl↓+ Ba(NO3)2
Tác dụng với kim loại:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Tác dụng với axit:
AgNO3 + HI → AgI ↓ + HNO3
Oxi hóa được muối sắt (II)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
7.3. Điều chế
Bạc nitrat điều chế bằng cách hòa tan kim loại bạc trong dung dịch axit nitric.
3Ag + 4 HNO3(loãng) → 3AgNO3 + 2H2O + NO
3Ag + 6 HNO3(đặc, nóng) → 3AgNO3 + 3 H2O + 3NO2
8. Bài tập vận dụng liên quan
Câu 1. Tiến hành các thí nghiệm sau
(a) Ngâm lá đồng trong dung dịch AgNO3
(b) Ngâm lá kẽm trong dung dịch HCl loãng
(c) Ngâm lá nhôm trong dung dịch NaOH
(d) Ngâm lá sắt được cuốn dây đồng trong dung dịch NaOH
(e) Để một vật bằng gang ngoài không khí ẩm
(f) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3
Số thí nghiệm xảy ra ăn mòn điện hóa là
A. 2
B. 1
C. 4
D. 3
Lời giải:
(a) tạo ra 2 kim loại là Cu và Ag nên là ăn mòn điện hóa
(b) là ăn mòn hóa học
(c) là ăn mòn hóa học
(d) là ăn mòn điện hóa
(e) là ăn mòn điện hóa
(f) là ăn mòn hóa học
Câu 2. Cho m gam Cu tác dụng vừa đủ với 200ml dung dịch AgNO3 1M. Tính giá trị m cần cho phản ứng?
A. 6,4
B. 3,2
C. 9,6
D. 8
Lời giải:
nAgNO3 = 0,2 mol
Phương trình phản ứng xảy ra
Cu + 2AgNO3→ Cu(NO3)2 + 2Ag
0,1 ← 0,2
mCu = 0,1.64 = 6,4 gam
Câu 3. Dãy kim loại nào dưới đây phản ứng được với dung dịch sắt (II) nitrat.
A. Cu, Fe, Ag
B. Al, Zn, Mg
C. Fe, Ag, Mg
D. Al, Cu, Zn
Lời giải:
Phương trình phản ứng
2Al + 3Fe(NO3)2 → 2Al(NO3)3 + 3Fe
Zn + Fe(NO3)2 → Zn(NO3)2 + Fe
Mg + Fe(NO3)2 → Mg(NO3)2 + Fe
Câu 4. Ngâm một thanh Cu vào dung dịch AgNO3 dư thu được dung dịch A. Sau đó ngâm thanh Fe (dư) vào dung dịch A thu được dung dịch B và chất rắn Z. Biết các phản ứng xảy ra hoàn toàn. Z có chứa chất nào sau đây?
A. Fe
B. Fe, Cu
C. Cu, Ag.
D. Fe, Cu, Ag
Lời giải:
Các phản ứng xảy ra:
Cu (dư) + AgNO3 → Cu(NO3)2 + Ag
Cu(NO3)2 + Fe(dư) → Fe(NO3)2+ Cu
Vậy dung dịch Y chứa Fe(NO3)2.
Câu 5. Cho 0,05 mol FeCl2 phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là
A. 28,7.
B. 19,75.
C. 10,8.
D. 17,9.
FeCl2 + 2AgNO3 → 2AgCl↓ + Fe(NO3)2
0,05 → 0,1
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓
0,05 → 0,1
=> mkết tủa = 0,05.108 + 0,1.143,5 = 19,75 gam
Câu 6. Nhúng thanh kim loại kẽm vào một dung dịch chứa hỗn hợp 6,4 gam CuSO4 và 12,8 gam CdSO4. Hỏi sau khi Cu và Cd bị đẩy hoàn toàn khỏi dung dịch thì khối lượng thanh kẽm tăng hay giảm bao nhiêu?
A. tăng 1,39 gam
B. giảm 1,39 gam
C. tăng 2,78 gam
D. giảm 2,78 gam
Lời giải:
Ta có:
nCuSO4 = 3,2160 = 0,04 (mol);
nCdSO4 = 6,24208 = 0,06 (mol)
Phương trình hóa học
CuSO4 + Zn → ZnSO4 + Cu (1)
0,04 → 0,04→ 0,04 (mol)
CdSO4 + Zn → ZnSO4 + Cd (2)
0,06 → 0,06 → 0,06 (mol)
Từ (1) và (2) ⇒ ∑mCu + Cd= (0,04.64) + (0,06.112) = 9,28 (gam)
Và mZn tham gia phản ứng = (0,04 + 0,06).65 = 6,5 (gam)
Vậy khối lượng thanh Zn tăng: 9,28 – 6,5 = 2,78 (gam)
Câu 7. Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sulfuric loãng đun nóng là vì
A. Phản ứng tạo ra kết tủa màu vàng và dung dịch có màu xanh
B. Phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm.
C. Phản ứng tạo ra kết tủa màu xanh.
D. Phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Lời giải:
Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sunfuric loãng đun nóng là vì phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Câu 8. Khi cho lá đồng vào dung dịch HNO3 đặc hiện tượng quan sát được là:
A. Dung dịch chuyển sang màu vàng và có khí màu nâu đỏ thoát ra
B. Dung dịch chuyển sang màu nâu đỏ và có khí màu xanh thoát ra
C. Dung dịch chuyển sang màu xanh và có khí không màu thoát ra
D. Dung dịch chuyển sang màu xanh và có khí màu nâu đỏ thoát ra
Lá đồng màu đỏ Đồng (Cu) tan dần trong dung dịch axit HNO3 đặc và sinh ra khí nito đioxit NO2 nâu đỏ.
Cu + 4HNO3 → Cu(NO3)2+ 2NO2↑ + 2H2O
Câu 9. Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch HCl dư, sinh ra 6,72 lít khí (ở đktc). Nếu cho m gam hỗn hợp X trên vào lượng dư axit nitric đặc, nguội, sinh ra 13,44 lít khí NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A. 10,5
B. 24,6
C. 12,3
D. 15,6
Lời giải:
Cho Al, Cu vào HCl dư thì chỉ có Al phản ứng:
Al + 3HCl → AlCl3 + 32H2
Ta có: nAl = 23.nH2 = 23. 0,3 = 0,2 mol
Cho Al, Cu vào HNO3 đặc nguội thì chỉ có Cu phản ứng:
Cu + 4HNO3→ Cu(NO3)2 + 2NO2 + 2H2O
Ta có: nCu = 12. nNO2 = 12. 0,6 = 0,3 mol
Vậy m gam hỗn hợp X gồm 0,1 mol Al và 0,3 mol Cu → m = 0,2.27+ 0,3.64 = 24,6 gam
Câu 10. Cho 0,774 gam hỗn hợp Zn và Cu vào 500 ml dung dịch AgNO3 nồng độ 0,04M. Sau khi các phản ứng xảy ra hoàn toàn được chất rắn X nặng 2,288 gam chất rắn. Hãy xác định thành phần của?
A. Ag và Cu
B. Zn và Ag
C. Cu
D. Ag
Lời giải:
Ta có: = 0,5.0,04 = 0,02(mol)
Thứ tự phản ứng:
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag (1)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag (2)
Nếu Zn, Cu phản ứng hết thì khối lượng kim loại thu được tối đa nặng:
108 . 0,02 = 2,16 (gam) < mX ⇒ kim loại còn dư ⇒ AgNO3 phản ứng hết.
Nếu Cu chưa phản ứng thì phản ứng (1) làm tăng một lượng:
108.0,02 – 65.0,022 = 1,51 (gam) tức khối lượng chất rắn lúc đó nặng:
0,774 + 1,51 = 2,284 (gam) < mX ⇒ Cu có phản ứng nhưng còn dư.
Vậy X gồm Ag và Cu.
Câu 11. Cho 1 gam kim loại R vào 200 ml dung dịch AgNO3 0,25M đến khi phản ứng hoàn toàn thu được dung dịch không chứa ion Ag+ và có khối lượng giảm so với khối lượng của dung dịch AgNO3 ban đầu là 4,4 gam. Kim loại R là?
A. Cu.
B. Ca.
C. Zn.
D. Fe.
Lời giải:
*Trường hợp 1: R (hóa trị n) phản ứng trực tiếp với AgNO3
Phương trình phản ứng:
R + nAgNO3→ R(NO3)n + nAg
0,05n → 0,05 → 0,05 mol
mdd giảm= mAg– mR pứ= 0,05.108 – 0,05Rn= 4,4
→Rn= 20 → Loại
*Trường hợp 2: R là Ca
Ca + H2O → Ca(OH)2+ H2
0,025 → 0,025 → 0,025 mol
Ca(OH)2 + 2AgNO3→ Ca(NO3)2+ 2AgOH ↓
0,025 → 0,05 → 0,05
2AgOH → Ag2O + H2O
0,05 → 0,025 mol
ndd giảm= mAg2O+ mH2 – mCa= 0,025.232 + 0,025.2 – 1= 4,85 gam: Loại
*Vậy R là Fe.
Câu 12. Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ số mol 1 : 2) vào nước (dư) được dung dịch X. Cho dung dịch AgNO3 (dư) vào X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 28,7
B. 68,2
C. 57,4
D. 21,8
Lời giải:
Gọi số mol của FeCl2 là x
Theo đề bài ta có: 127x + 58,5.2.x = 24,4 => x = 0,1.
FeCl2 + 2AgNO3→ 2AgCl + Fe(NO3)2
0,1——> 0,2——–> 0,2——-> 0,1 mol
NaCl + AgNO3 → AgCl + NaNO3
0,2——-> 0,2——> 0,2
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
0,1———————————> 0,1
m = (0,2 + 0,2).143,5 + 108.0,1 = 68,2 (g)
Câu 13. Có 4 dung dịch đựng riêng biệt: (a) HCl; (b) CuCl2; (c) FeCl2; (d) HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh sắt nguyên chất. Số trường hợp xảy ra ăn mòn điện hóa là
A. 0
B. 1
C. 3
D. 2
Lời giải:
Để xảy ra quá trình ăn mòn điện hóa cần thỏa mãn 3 điều kiện:
Có 2 điện cực khác bản
2 điện cực tiếp xúc trực tiếp hoặc gián tiếp với nhau
2 điện cực được nhúng trong cùng 1 dung dịch chất điện li
Có 2 trường hợp thỏa mãn: Fe nhúng vào dung dịch CuCl2 và Fe nhúng vào dung dịch CuCl2 + HCl
Câu 14. Nhận định nào sau đây không đúng?
A. Phản ứng thế trong hóa học vô cơ đều là phản ứng oxi hóa – khử.
B. Các phản ứng trao đổi có thể là phản ứng oxi hóa – khử, có thể không là phản ứng oxi hóa khử.
C. Các phản ứng hóa hợp có thể là phản ứng oxi hóa – khử, có thể không là phản ứng oxi hóa khử.
D. Các phản ứng trao đổi đều không phải là phản ứng oxi hóa khử.
Lời giải:
Xem thêm các phương trình hóa học khác:
CuO + HCl → CuCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
CuO + H2 → Cu + H2O
CuO + HNO3 → Cu(NO3)2 + H2O
CuSO4 + NaOH → Cu(OH)2 + Na2SO4
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




