Phản ứng Fe + S → FeS↓màu đen
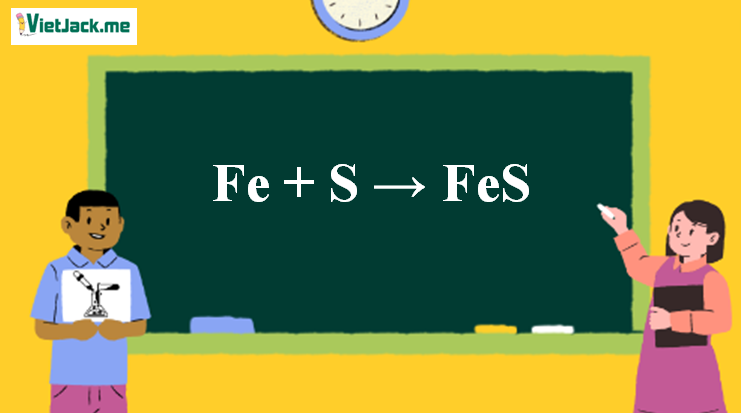
1. Phương trình phản ứng giữa Fe và FeS
Fe + S → FeS↓màu đen
Hỗn hợp gồm bột sắt và bột lưu huỳnh nếu được đun nhẹ lúc đầu thì phản ứng xảy ra rất mạnh, toả nhiều nhiệt.
2. Điều phản ứng giữa Fe và FeS xảy ra
Nhiệt độ
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Fe (Sắt)
– Trong phản ứng trên Fe là chất khử.
– Fe tác dụng được với các phi kim như S, O2, Cl2, …
3.2. Bản chất của S (Lưu huỳnh)
– Trong phản ứng trên S là chất oxi hoá,
– S thể hiện tính oxi hoá khi tác dụng với kim loại và H2.
4. Mở rộng tính chất hóa học của lưu huỳnh
Thể hiện tính oxi hóa
Tác dụng với kim loại.
Thuỷ ngân phản ứng với lưu huỳnh ở ngay nhiệt độ thường:
Hg + S → HgS
Tác dụng với hidro
Lưu huỳnh cũng phản ứng trực tiếp với hiđro. Khi dẫn hiđro vào ống nghiệm đứng lưu huỳnh đang sôi thì ở đầu ống dẫn khí xuất hiện khí mùi trứng thối, đó là hiđro sunfua:
H2 + S H2S
Thể hiện tính khử
Lưu huỳnh tác dụng hầu như với tất cả các phi kim, trừ nitơ và iot.
S + O2 → SO2
Tác dụng với các chất oxi hóa khác
3S + 2KClO3 → 2KCl + 3SO2
S + 6HNO3 (đặc) → H2SO4 + 6NO2 + 2H2O.
5. Tính chất hoá học của Fe
Sắt là kim loại có tính khử trung bình, tùy theo các chất oxi hóa mà sắt có thể bị oxi hóa lên mức +2 hay +3.
Fe → Fe2+ + 2e
Fe → Fe3+ + 3e
5.1. Tác dụng với phi kim
a. Tác dụng với lưu huỳnh
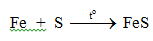
b. Tác dụng với oxi
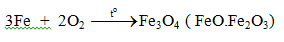
c. Tác dụng với clo
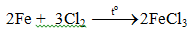
5.2. Tác dụng với axit
a. Tác dụng với dung dịch axit HCl, H2SO4 loãng
Fe + 2H+ → Fe2+ + H2
b. Với các axit HNO3, H2SO4 đặc
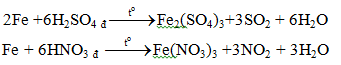
Fe + 4HNO3 l → Fe(NO3)3 + NO + 2H2O
Chú ý: Với HNO3 đặc, nguội; H2SO4 đặc, nguội: Fe bị thụ động hóa.
5.3. Tác dụng với dung dịch muối
Fe đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
Fe+ CuSO4 → FeSO4 + Cu
Chú ý:
Fe + 2Ag+ → Fe2+ + 2Ag
Ag+ dư + Fe2+ → Fe3+ + Ag
5.4. Ứng dụng của Fe
– Sắt có trong những đồ dùng cá nhân như: dao, kềm, kéo, kệ sắt, các loại dụng cụ gia đình khác,…
– Sắt ở trong các đồ nội thất như: bàn ghế, khung cửa, tủ kệ, cầu thang,…
– Các loại máy móc trong gia đình như máy xay, máy giặt, bồn rửa cũng có sắt.
– Trong giao thông vận tải sắt cũng đóng vai trò rất quan trọng.
– Sắt là bộ khung sườn cho những công trình xây dựng như nhà cửa, cầu, tòa nhà,…
6. Bài tập vận dụng liên quan
Câu 1. Cho các phản ứng hóa học sau:
S + O2 SO2
S + 3F2 SF6
S + Hg → HgS
S + 6HNO3 (đặc) H2SO4 + 6NO2 + 2H2O
Trong các phản ứng trên, số phản ứng trong đó S thể hiện tính khử là
A. 3
B. 2
C. 4
D. 1
Lời giải:
Câu 2. Cấu hình electron ở trạng thái kích thích của S khi tạo SO2 là:
A. 1s22s22p63s23p4
B. 1s22s22p63s23p33d1
C. 1s22s22p63s23p23d2
D. 1s22s22p63s23p33d2
Lời giải:
Câu 3. Đun nóng 9,75 gam kali với một phi kim X dư thu được 13,75 gam muối. Hỏi X là phi kim nào sau đây?
A. Cl
B. Br
C. S
D. N
Lời giải:
Câu 4. Cho 11 gam hỗn hợp bột sắt và bột nhôm tác dụng với bột lưu huỳnh trong điều kiện không có không khí) thấy có 12,8 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 11 gam hỗn hợp đầu là
A. 5,6 gam.
B. 11,2 gam.
C. 2,8 gam.
D. 8,4 gam.
Lời giải:
Câu 5. Ứng dụng nào sau đây là ứng dụng chính của lưu huỳnh?
A. Chế tạo dược phẩm, phẩm nhuộm
B. Sản xuất H2SO4
C. Lưu hóa cao su
D. Chế tạo diêm, thuốc trừ sâu, diệt nấm
Lời giải:
Đáp án: B
Xem thêm các phương trình hóa học khác:
Fe + Cl2 → FeCl3
Fe + CuSO4 → FeSO4 + Cu
Fe + AgNO3 → Fe(NO3)2 + Ag
Fe + H2SO4 → FeSO4 + H2
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




