Phản ứng FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4+ H2O
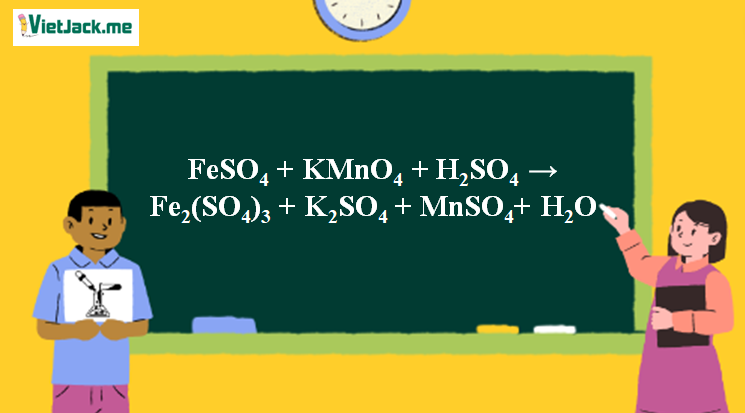
1. Phương trình phản ứng FeSO4 + KMnO4 + H2SO4
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4+ 8H2O
2. Cân bằng phương trình phản ứng FeSO4+ KMnO4 + H2SO4 thăng bằng e
Bước 1. Xác định sự thay đổi số oxi hóa của các chất
Fe+2SO4 + KMn+7O4 + H2SO4 → Fe+32(SO4)3 + Mn+2SO4 + K2SO4 + H2O
FeSO4 đóng vai trò là chất khử
KMnO4 là chất oxi hóa
Bước 2: Viết quá trình oxi hóa, quá trình khử
|
Quá trình oxi hóa: 5x Quá trình khử: 2x |
2Fe+2 → 2Fe+3 + 2e Mn+7 + 5e → Mn+2 |
Bước 3: Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
3. Hiện tượng giải thích
Nhỏ từ từ đến dư dung dịch FeSO4 đã được axit hóa bằng H2SO4vào dung dịch KMnO4. Hiện tượng quan sát được dung dịch màu tím hồng bị nhạt dần rồi chuyển sang màu vàng.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của FeSO4 (Sắt sunfat)
– Trong phản ứng trên FeSO4 là chất khử.
– FeSO4 mang đầy đủ tính chất hoá học của muối thể hiện tính khử khi tác dụng với Cl2, H2SO4 đặc nóng, KMnO4, …
4.2. Bản chất của KMnO4 (Thuốc tím)
Trong phản ứng trên KMnO4 là chất oxi hoá.
5. Tính chất hóa học của FeSO4
– Mang đầy đủ tính chất hóa học của muối.
– Có tính khử và tính oxi hóa:
Tính khử: Fe2+ → Fe3+ + 1e
Tính oxi hóa: Fe2+ + 1e → Fe
5.1. Tính chất hóa học của muối
– Tác dụng với dung dịch kiềm:
FeSO4 + KOH → K2SO4 + Fe(OH)2
– Tác dụng với muối:
FeSO4 + BaCl2 → BaSO4 + FeCl2.
5.2. Tính khử
FeSO4 + Cl2 → FeCl3 +Fe2(SO4)3
2FeSO4 + 2H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + 2H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
5.3. Tính oxi hóa
FeSO4 + Mg → MgSO4 + Fe
5.4. Ứng dụng của FeSO4
– FeSO4 được sử dụng chủ yếu như 1 hóa chất keo tụ cũng như một chất dùng trong phản ứng oxi hóa khử để loại bỏ photphat trong nước của các nhà máy xử lý nước thải đô thị và công nghiệp.
– FESO4 – sắt sunfat mang tính chất là một chất khử nên được ứng dụng trong việc khử cromat trong xi măng thành các hợp chất Cr (III) ít độc hơn.
-FeSO4 – sắt sunfat còn được sử dụng trong ngành dệt may như một chất cố định thuốc nhuộm . Nó được sử dụng trong lịch sử để làm đen da và như là một thành phần của mực.
– FeSO4 – sắt sunfat được sử dụng để củng cố thực phẩm và điều trị và ngăn ngừa thiếu máu do thiếu sắt .
-FeSO4 – sắt sunfat là một nguyên tố vi lượng quan trọng mà cơ thể cần để sản xuất các tế bào hồng cầu, giúp cơ thể bạn khỏe mạnh.
6. Tính chất hoá học của KMnO4
Vì là chất oxi hóa mạnh nên KMnO4 có thể phản ứng với kim loại hoạt động mạnh, axit hay các hợp chất hữu cơ dễ dàng.
6.1. Phản ứng KMnO4 phân hủy
2KMnO4 → K2MnO4+ MnO2 + O2
Khi pha loãng tinh thể pemanganat dưới ánh sáng mặt trời trực tiếp, oxi được giải phóng
4KMnO4 + 2H2O → 4KOH + 4MnO2+ 3O2
6.2. Phản ứng với axit
KMnO4 có thể phản ứng với nhiều axit mạnh như H2SO4, HCl hay HNO3, các phương trình phản ứng minh họa gồm:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3K2MnO4+ 4HNO3 → 2KMnO4 + MnO2 + 4KNO3 + 2H2O
6.3. Phản ứng với bazơ
Thuốc tím có thể tác dụng với nhiều dung dịch kiềm hoạt động mạnh như KOH, NaOH, phương trình phản ứng minh họa:
4KMnO4 + 4KOH → 4K2MnO4+ 2H2O + O2
6.4. Tính chất oxy hóa của KMnO4
Vì thuốc tím là chất oxy hóa mạnh nên có thể phản ứng với nhiều loại dung dịch và cho ra nhiều sản phẩm khác nhau.
- Trong môi trường axit, mangan bị khử thành Mn2+
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
- Trong môi trường trung tính, tạo thành MnO2 có cặn màu nâu.
2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH
- Trong môi trường kiềm, bị khử thành MnO42-
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
7. Câu hỏi vận dụng liên quan
Câu 1. Dung dịch FeSO4 không làm mất màu dung dịch nào sau đây?
A. Dung dịch KMnO4trong môi trường H2SO4
B. Dung dịch K2Cr2O7 trong môi trường H2SO4
C. Dung dịch Br2
D. Dung dịch CuCl2
Lời giải:
Đáp án D
Phương trình hóa học phản ứng xảy ra
FeSO4 tác dụng với dung dịch KMnO4 trong môi trường H2SO4 có làm mất màu thuốc tím
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4+ 2MnSO4 + 8H2O
FeSO4 tác dụng với dung dịch K2Cr2O7 trong môi trường H2SO4 có làm mất màu thuốc tím
6FeSO4 + K2Cr2O7+ 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4+ 7H2O
FeSO4 tác dụng với dung dịch Dung dịch Br2 có làm mất màu thuốc tím
3Br2 + 6FeSO4 ⟶ 2Fe2(SO4)3 + 2FeBr3
Câu 2. Nhỏ từ từ đến dư dung dịch FeSO4 đã được axit hóa bằng H2SO4 vào dung dịch KMnO4. Hiện tượng quan sát được là:
A. dung dịch màu tím hồng bị nhạt dần rồi chuyển sang màu vàng
B. dung dịch màu tím hồng bị nhạt dần đến không màu
C. dung dịch màu tím hồng bị chuyển dần sang nâu đỏ
D. màu tím bị mất ngay. Sau đó dần dần xuất hiện trở lại thành dung dịch có màu hồng
Lời giải:
Đáp án A
Nhỏ từ từ đến dư dung dịch FeSO4 đã được axit hóa bằng H2SO4 vào dung dịch KMnO4
10FeSO4 + 8H2SO4 + 2KMnO4→ 5Fe2(SO4)3 + 2MnSO4 + 8H2O + K2SO4
muối Fe2(SO4)3 và FeCl3 có màu vàng
Câu 3. Cho phương trình phản ứng:
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4+ H2O.
Khi hệ số của các chất là số nguyên, nhỏ nhất thì hệ số của chất khử là
A. 10
B. 8
C. 6
D. 2
Lời giải:
Đáp án A
Phương trình phản ứng xảy ra:
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4+ 8H2O
Chất khử là FeSO4 có hệ số là 10.
Câu 4. Cho phương trình phản ứng:
KMnO4 + FeSO4+ H2SO4→ Fe2(SO4)3 + K2SO4+ MnSO4 + H2O
Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là :
A. 5 và 2
B. 2 và 10
C. 2 và 5
D. 10 và 2
Lời giải:
Đáp án B
Phương trình phản ứng xảy ra
2KMnO4 + 10FeSO4+ 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Chất oxi hóa là KMnO4 có hệ số là 2
Chất khử là FeSO4 có hệ số là 10
Câu 5. Cho chất X (CrO3) tác dụng với lượng dư NaOH, thu được hợp chất Y của crom. Đem chất Y cho tác dụng với dung dịch H2SO4 loãng, dư, thu được hợp chất Z của crom. Đem chất Z tác dụng với dung dịch HCl dư, thu được khí T. Phát biểu nào sau đây không đúng?
A. Chất Z là Na2Cr2O7
B. Khí T có màu vàng lục
C. Chất X có màu đỏ thẫm
D. Chất Y có màu da cam
Lời giải:
Đáp án D
Phương trình minh họa cho nội dung câu trả lời
CrO3 + 2NaOH → Na2CrO4 (Y)+ H2O
→ X có màu đỏ thẫm → C đúng
Y có màu vàng → D sai
2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
→ Z là Na2Cr2O7 → A đúng
Z + HCl : Na2Cr2O7 + 14HCl → 2NaCl + 2CrCl3 + 7H2O + 3Cl2
→ khí T là Cl2 → B đúng
Câu 6. Hòa tan 12,6 gam Fe bằng dung dịch H2SO4 loãng dư, thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là:
A. 180.
B. 90
C. 45
D. 135
Lời giải:
Đáp án B
Phương trình phản ứng hóa học:
Fe + H2SO4 → FeSO4 + H2
0,225 → 0,225 (mol)
10FeSO4 + 2KMnO4 + 8H2SO4→ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
0,225 → 0,045(mol)
=> Vdd KMnO4 = 0,045:0,5 = 0,09 lít = 90 ml
Câu 7. Cho 2,4 gam một kim loại tác dụng với lượng khí clo vừa đủ sau phản ứng thu được 9,5 gam một chất có công thức là MCl2. Kim loại M là:
A. Fe.
B. Cu.
C. Mg.
D. Zn.
Lời giải:
Đáp án C
Bảo toàn khối lượng:
mM + mCl2 = mMCl2 => mCl2 = 9,5 − 2,4=7,1gam
=>nCl2= 0,1 mol
Xét quá trình cho – nhận e và áp dụng bảo toàn e:
M → +2M + 2e
0,1 ← 0,2
Cl2+ 2e → 2Cl−1,
0,1→0,2
=> nM = 0,1 mol =>MM= 2,4/0,1= 24
=> M là kim loại Mg
Câu 8. Cho dãy các chất: SiO2, Cr(OH)3, CrO3, Zn(OH)2, NaHCO3, Al2O3. Số chất trong dãy tác dụng được với dung dịch NaOH (đặc, nóng) là:
A. 6
B. 3
C. 5
D. 4
Lời giải:
Đáp án A
Số chất tác dụng được với dung dịch NaOH đặc nóng là 6
Phương trình phản ứng minh họa:
SiO2 + 2NaOH → Na2SiO3 + H2O
Cr(OH)3+ NaOH → Na[Cr(OH)4]
2NaOH + Zn(OH)2 → Na2[Zn(OH)4]
NaOH + NaHCO3 → Na2CO3 + H2O
CrO3 + 2NaOH → Na2CrO4+ H2O
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Câu 9. Cho vào ống nghiệm một vài tinh thể K2Cr2O7, sau đó thêm tiếp khoảng 1 ml nước và lắc đều để K2Cr2O7 tan hết, thu được dung dịch X. Thêm vài giọt dung dịch NaOH vào dung dịch X, thu được dung dịch Y. Màu sắc của dung dịch X và Y lần lượt là
A. màu da cam và màu vàng chanh.
B. màu vàng chanh và màu da cam.
C. màu nâu đỏ và màu vàng chanh.
D. màu vàng chanh và màu nâu đỏ.
Lời giải:
Đáp án A
Phương trình ion thu gọn
Cr2O72- + 2OH– ⇆ 2CrO42- + H2O
màu da cam màu vàng
Khi nhỏ từ từ dung dịch KOH vào dung dịch K2Cr2O7thì cân bằng trên chuyển dịch sang phải
=> dung dịch chuyển từ màu da cam sang màu vàng
Câu 10. Dung dịch trong nước của chất nào dưới đây có màu da cam?
A. K2Cr2O7.
B. KCl.
C. K2CrO4.
D. KMnO4.
Lời giải:
Đáp án A
A. dung dịch K2Cr2O7 có màu da cam
B. dung dich KCl không có màu
C. dung dich K2CrO4 có màu vàng.
D. dung dich KMnO4 có màu tím
Câu 11. Trong công nghiệp, từ quặng cromit (FeO.Cr2O3) người ta điều chế Cr bằng phương pháp nào sau đây?
A. tách quặng rồi thực hiện điện phân nóng chảy Cr2O3.
B. tách quặng rồi thực hiện phản ứng nhiệt nhôm Cr2O3.
C. tách quặng rồi thực hiện phản ứng khử Cr2O3bởi CO.
D. hòa tan quặng bằng HCl rồi điện phân dung dịch CrCl3.
Lời giải:
Đáp án B
Người ta điều chế Cr bằng phương pháp tách quặng rồi thực hiện phản ứng nhiệt nhôm Cr2O3.
Câu 12. Các số oxi hoá đặc trưng của crom là
A. +2, +4, +6.
B. +2, +3, +6.
C. +1, +2, +4, +6.
D. +3, +4, +6.
Lời giải:
Đáp án B
Các số oxi hoá đặc trưng của crom là +2, +3, +6.
Câu 13. Cho dãy các chất: SiO2, Cr(OH)3, CrO3, Zn(OH)2, NaHCO3, Al2O3. Số chất trong dãy tác dụng được với dung dịch NaOH (đặc, nóng) là:
A. 6
B. 3
C. 5
D.4
Lời giải:
Đáp án A
SiO2 + 2NaOH → Na2SiO3+ H2O
Cr(OH)3 + NaOH → Na[Cr(OH)4]
2NaOH + Zn(OH)2 → Na2[Zn(OH)4]
NaOH + NaHCO3 → Na2CO3 + H2O
CrO3 + 2NaOH → Na2CrO4 + H2O
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Câu 14. Cho chất X (CrO3) tác dụng với lượng dư NaOH, thu được hợp chất Y của crom. Đem chất Y cho tác dụng với dung dịch H2SO4 loãng, dư, thu được hợp chất Z của crom. Đem chất Z tác dụng với dung dịch HCl dư, thu được khí T. Phát biểu nào sau đây không đúng?
A. Chất Z là Na2Cr2O7
B. Khí T có màu vàng lục
C. Chất X có màu đỏ thẫm
D. Chất Y có màu da cam
Lời giải:
Đáp án D
CrO3 + 2NaOH → Na2CrO4 (Y)+ H2O
→ X có màu đỏ thẫm → C đúng
Y có màu vàng → D sai
2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
→ Z là Na2Cr2O7 → A đúng
Z + HCl : Na2Cr2O7 + 14HCl → 2NaCl + 2CrCl3 + 7H2O + 3Cl2
→ khí T là Cl2 → B đúng
Fe3O4 + HNO3 → Fe(NO3)3 + NO2 + H2O
FeSO4 + NaOH → Fe(OH)2 + Na2SO4
FeSO4 + HNO3 → Fe(NO3)3 + H2SO4 + NO2 + H2O
FeSO4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Fe(OH)2 + HNO3 → Fe(NO3)3 + NO2 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




