Phản ứng K + Cl2 → KCl
1. Phản ứng hóa học
2K + Cl2 → 2KCl
2. Điều kiện phản ứng
Nhiệt độ.
3. Cách thực hiện phản ứng
Cho kali tác dụng với khí clo thu được muối kaliclorua.
4. Hiện tượng nhận biết phản ứng
Kali nóng chảy cháy sáng trong khí clo tạo muối màu trắng.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K (Kali)
– Trong phản ứng trên K là chất khử.
– K là kim loại kiềm có tính khử rất mạnh, K phản ứng với halogen toả nhiều nhiệt tạo thành muối.
5.2. Bản chất của Cl2 (Clo)
– Trong phản ứng trên Cl2 là chất oxi hoá.
– Cl2 có khả năng cho phản ứng với hầu hết các kim loại (trừ Au và Pt) ở điều kiện nhiệt độ để tạo thành các muối halogenua. (Muối thu được thường ứng với hóa trị cao nhất của kim loại tham gia phản ứng)
6. Tính chất hoá học của K
Kali là kim loại kiềm có tính khử rất mạnh.
K → K+ + 1e
6.1. Tác dụng với phi kim
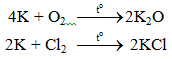
6.2. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
6.3. Tác dụng với nước
K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
6.4. Tác dụng với hidro
Kali tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
7. Tính chất vật lí của Kali
– Kali là kim loại nhẹ thứ hai sau liti, là chất rắn rất mềm, dễ dàng cắt bằng dao và có màu trắng bạc.
– Kali bị ôxi hóa rất nhanh trong không khí và phải được bảo quản trong dầu mỏ hay dầu lửa.
– Có khối lượng riêng là 0,863 g/cm3; có nhiệt độ nóng chảy là 63,510C và sôi ở 7600C.
8. Tính chất hóa học của Cl2
8.1. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất)
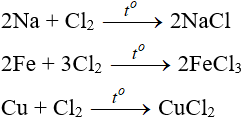
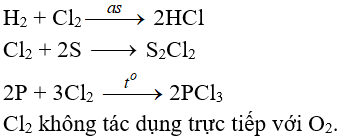
8.2. Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
8.3. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất oxi hóa, vừa là chất khử.
Tác dụng với nuớc:
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với dung dịch bazơ:
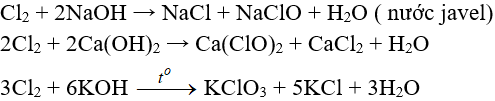
8.4. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
8.5. Tác dụng với chất khử khác
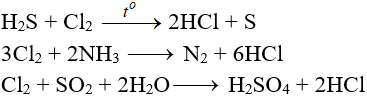
8.6. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
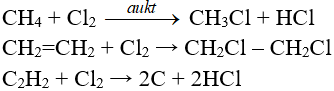
9. Câu hỏi vận dụng
Câu 1. Cách bảo quản K đúng nhất :
A. Để ngoài không khí
B. Ngâm trong rượu
C. Ngâm trong dầu hỏa
D. Ngâm trong nước tinh khiết
Lời giải:
Đáp án C
Câu 2. Cho 1,95 g Na đun nóng trong khí clo thu được m g muối. Giá trị của m là:
A. 7,45 g B. 3,725 g
C. 14,9 g D. 1,49 g
Lời giải:
Đáp án B
Phương trình hóa học: 2K + Cl2 → 2KCl
NKCl = nK = 0,05 mol ⇒ mKCl = 0,05.74,5 = 3,725 g
Câu 3. Cho K tác dụng với Clo nung nóng. Hiện tượng phản ứng xảy ra là:
A. Kali nóng chảy cháy sáng trong khí clo
B. Kali phản ứng dịu nhẹ với khí clo
C. Kali phản ứng tỏa nhiều nhiệt khi tác dụng với khí clo đun nóng.
D. Kali tác dụng mãnh liệt với khí clo khi tiếp xúc.
Lời giải:
Đáp án A
Xem thêm các phương trình phản ứng hóa học khác:
K + Br2 → KBr
K + I2 → KI
K + O2 → K2O
K + S → K2S
K + HCl → KCl + H2
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




