Phản ứng K + Zn(NO3)2 + H2O → KNO3 + H2 + Zn(OH)2
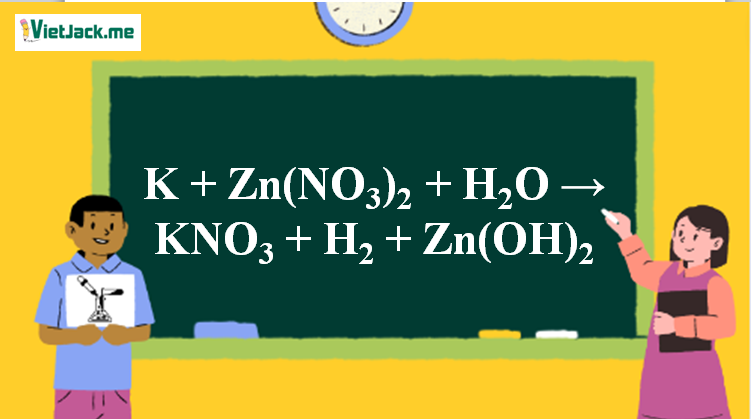
1. Phản ứng hóa học
2K + Zn(NO3)2 + 2H2O → 2KNO3 + H2 + Zn(OH)2
2. Điều kiện phản ứng
Không cần điều kiện
3. Cách thực hiện phản ứng
Cho kali tác dụng với dung dịch muối kẽm nitrat.
4. Hiện tượng nhận biết phản ứng
K tan dần trong dung dịch muối kẽm, có kết tủa màu trắng tạo thành và có khí thoát ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K (Kali)
– Trong phản ứng trên K là chất khử.
– K là chất khử mạnh, K tham gia phản ứng với các dung dịch muối như Cr3+; Al3+; Zn2+ thì nếu K dư sẽ hòa tan được kết tủa tạo thành.
5.2. Bản chất của Zn(NO3)2 (Kẽm nitrat)
Zn(NO3)2 mang tính chất hoá học của muối tác dụng được với dung dịch kiềm.
6. Tính chất hoá học của K
Kali là kim loại kiềm có tính khử rất mạnh.
K → K+ + 1e
6.1. Tác dụng với phi kim
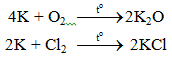
6.2. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
6.3. Tác dụng với nước
K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
6.4. Tác dụng với hidro
Kali tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
7. Tính chất vật lý của K
Kali là kim loại nhẹ thứ hai sau liti, là chất rắn rất mềm, dễ dàng cắt bằng dao và có màu trắng bạc. – Kali bị ôxi hóa rất nhanh trong không khí và phải được bảo quản trong dầu mỏ hay dầu lửa. – Có khối lượng riêng là 0,863 g/cm3; có nhiệt độ nóng chảy là 63,510C và sôi ở 7600C.
8. Tính chất hóa học của Zn(NO3)2
Mang tính chất hóa học của muối:
Tác dụng với muối:
Zn(NO3)2 + Na2CO3 → ZnCO3 + 2NaNO3
Tác dụng với kim loại:
Mg + Zn(NO3)2→ Mg(NO3)2 + Zn
Tác dụng với dung dịch bazơ:
Zn(NO3)2 + 2KOH → Zn(OH)2 + 2KNO3
Zn(NO3)2+ 2NH3 + 2H2O → Zn(OH)2 + 2NH4NO3
Bị phân hủy bởi nhiệt:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
9. Câu hỏi vận dụng
Câu 1. Khi cho 3,9 g K tác dụng với 200 g dung dịch muối kẽm nitrat. Sau phản ứng thấy có khí thoát ra và chất kết tủa X. Khối lượng dung sau phản ứng là:
A. 202,3 g B. 200 g
C. 202,2 g D. 198,95 g
Lời giải:
Đáp án D
Phương trình hóa học: 2K + Zn(NO3)2 + 2H2O → 2KNO3 + H2 + Zn(OH)2
nH2 = nK/2 = 0,1/2 = 0,05 mol ⇒ mH2 = 0,05.2 = 0,1 g
nZn(OH)2 = nK/2 = 0,05 mol ⇒ mZn(OH)2 = 0,05 .99 = 4,95 g
mdd = 3,9 + 200 – 0,1 – 4,95 = 198,95 g
Câu 2. Khi cho K tác dụng vừa đủ với dung dịch muối kẽm nitrat thu được dung dịch A. Cô cạn dung dịch muối A thu được 1,01 g chất rắn. Khối lượng K tham gia phản ứng là:
A. 0,39 g B. 3,9 g
C. 1,95 g D. 0,195 g
Lời giải:
Đáp án A
Phương trình hóa học: 2K + Zn(NO3)2 + 2H2O → 2KNO3 + H2 + Zn(OH)2
nK = nKNO3 = 0,01 mol ⇒ mK = 0,01.39 = 0,39 g
Câu 3. Khi cho K dư vào 3 cốc dựng dung dịch FeCl3; Zn(NO3)2; Al2(SO4)3 thì hiện tượng xảy ra ở 3 cốc là:
A. Có khí thoát ra B. Có kết tủa
C. Kết tủa tan D. A và C
Lời giải:
Đáp án A
Xem thêm các phương trình phản ứng hóa học khác:
K + Pb(NO3)2 + H2O → KNO3 + H2 + Pb(OH)2
K + Fe(NO3)3 + H2O → KNO3 + H2 + Fe(OH)3
K + C2H5OH → C2H5OK + H2
K + CH3OH → CH3OK + H2
K + CH3COOH → CH3COOK + H2
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




