Phản ứng KClO3 + C → KCl + CO2↑
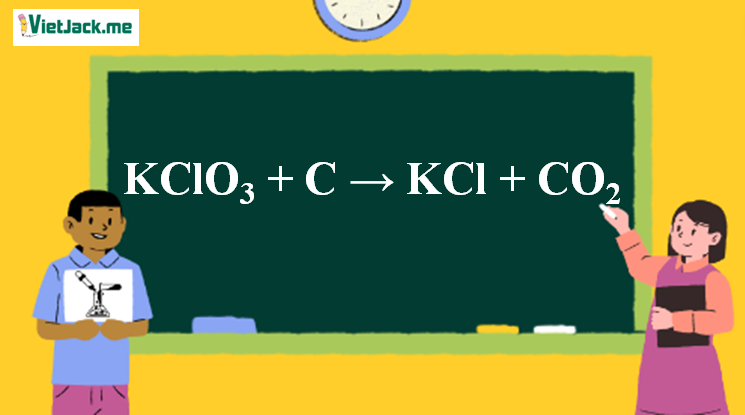
1. Phương trình phản ứng KClO3 ra KCl
2KClO3 + 3C 2KCl + 3CO2↑
2. Điều kiện phản ứng xảy ra
Điều kiện: Nhiệt độ
Cách thực hiện: cho cacbon tác dụng với KClO3
3. Hiện tượng khi KClO3 tác dụng với C
Có khí thoát ra
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của KClO3 (Kali clorat)
Trong phản ứng trên KClO3 là chất oxi hoá.
4.2. Bản chất của C (Cacbon)
– Trong phản ứng trên C là chất khử.
– C tác dụng được với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, … trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
5. Tính chất hóa học của C
– Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
– Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
5.1. Tính khử
– Tác dụng với oxi
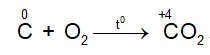
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
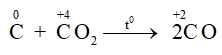
– Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
– Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, … trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
– Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
5.2. Tính oxi hóa
– Tác dụng với hidro
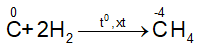
– Tác dụng với kim loại
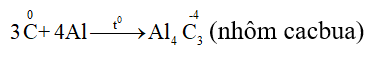
6. Điều chế Cacbon
– Kim cương nhân tạo được điều chế bằng cách nung than chì ở 2000oC, p từ 50 – 100 nghìn atm, xúc tác là Fe, Cr, Ni.
– Than chì nhân tạo được điều chế bằng cách nung than cốc ở 2500 – 3000oC trong lò điện, không có không khí.
– Than cốc được điều chế bằng cách nung than mỡ khoảng 1000oC trong lò cốc, không có không khí.
– Than gỗ được tạo nên khi đốt cháy gỗ trong điều kiện thiếu không khí.
– Than muội được tạo nên khi nhiệt phân metan ở điều kiện nhiệt độ và xúc tác thích hợp.
– Than mỏ được khai thác trực tiếp từ các vỉa than nằm sâu dưới mặt đất.
7. Bài tập vận dụng liên quan
Câu 1. Công thức phân tử CaCO3 tương ứng với thành phần hóa học chính của loại đá nào sau đây?
A. Đá đỏ.
B. Đá vôi.
C. Đá mài.
D. Đá tổ ong.
Lời giải:
Câu 2. Thạch cao nung được dùng để đúc tượng, bó bột khi gãy xương. Công thức phân tử của thạch cao nung là:
A. CaSO4.2H2O.
B. CaSO4.5H2O.
C. CaSO4.H2O.
D. CaSO4.
Lời giải:
Câu 3. Chất nào sau đây không phải dạng thủ hình của cacbon?
A. than chì
B. thạch anh
C. kim cương
D. cacbon vô định hình
Lời giải:
Câu 4. Cho m gam than (C) tác dụng với dung dịch HNO3 đặc nóng dư thu được 16,8 lít hỗn hợp X gồm 2 khí (đktc) (NO2 là sản phẩm khử duy nhất). Giá trị của m là
A. 1,2.
B. 0,6.
C. 1,8.
D. 3.
Lời giải:
C + 4HNO3 → CO2 + 4NO2 + 2H2O
x x 4x
5x = 0,75 ⇒ x = 0,15 ⇒ m = 1,8 gam
Xem thêm các phương trình hóa học khác:
(NH4)2SO4 + BaCl2 → NH4Cl + BaSO4
(NH4)2SO4 + NaOH → Na2SO4 + NH3 + H2O
Pb(OH)2 + NaOH → Na2PbO2 + H2O
HClO + KOH → KClO + H2O
Hoàn thành sơ đồ sau: S → SO2 → SO3 → H2SO4
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




