Phản ứng Li + HCl → LiCl + H2

1. Phản ứng hóa học
2Li + 2HCl → 2LiCl + H2
2. Điều kiện phản ứng
Không cần điều kiện
3. Cách thực hiện phản ứng
Cho liti tác dụng với axit clohidric tạo muối
4. Hiện tượng nhận biết phản ứng
Li tan dần trong dung dịch HCl và có khí thoát ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Li (Liti)
– Trong phản ứng trên Li là chất khử.
– Li có tính khử rất mạnh, dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng…) thành hidro tự do.
5.2. Bản chất của HCl (Axit clohidric)
– Trong phản ứng trên HCl là chất oxi hóa.
– HCl tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học (trừ Pb) tạo thành muối và giải phóng khí hidro.
6. Tính chất hóa học của Li
Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
6.1. Tác dụng với phi kim
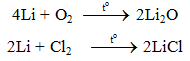
6.2. Tác dụng với axit
Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng…) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
6.3. Tác dụng với nước
Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
6.4. Tác dụng với hidro
Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
7. Tính chất vật lý của Li
– Kim loại kiềm. Trắng – bạc. Nhẹ nhất trong các kim loại, mềm, dễ nóng chảy.
– Có khối lượng riêng là 0,534 g/cm3; có nhiệt độ nóng chảy là 180,50C và sôi ở 1336,60C
8. Tính chất hoá học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
8.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl–
8.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 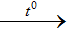 FeCl2 + H2
FeCl2 + H2
2Al + 6HCl 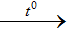 2AlCl3 + 3H2
2AlCl3 + 3H2
Cu + HCl → không có phản ứng
8.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 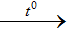 CuCl2 + H2 O
CuCl2 + H2 O
Fe2 O3 + 6HCl 2FeCl3 + 3H2 O
2FeCl3 + 3H2 O
8.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2  MnCl2 + Cl + 2H2 O
MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan (cường thuỷ) có khả năng hoà tan được Au (vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
9. Câu hỏi vận dụng
Câu 1. Hòa tan hoàn toàn Li vào 100 ml dung dịch HCl 1M, thấy thoát ra V lít khí (dktc) và dung dịch X. Trung hòa dung dịch X thấy hết 500 ml dung dịch NaOH 0,1M. Giá trị của V là:
A. 1,12 lit B. 0,56 lít C. 5,6 lít D. 2,24 lít
Lời giải:
Đáp án: B
Phương trình phản ứng: 2Li + 2HCl → 2LiCl + H2 (1)
NaOH + HCl → NaCl + H2O (1)
nHCl(1) = 0,1- 0,05 = 0,05 mol
nH2 = nHCl(1)/2 = 0,05/2 = 0,025 mol ⇒ VH2 = 0,025.22,4 = 0,56 lít
Câu 2. Cho a g Li tác dụng với dung dịch HCl vừa đủ thu được 2,24 lít khí đktc và dung dịch X. Cho dung dịch X tác dụng với dung dịch AgNO3 dư thu được m g kết tủa. Giá trị của m là:
A. 7,175 g B. 14,35g C. 28,7 g D. 2,87 g
Lời giải:
Đáp án: C
Phương trình phản ứng: 2Li + 2HCl → 2LiCl + H2
LiCl + AgNO3 → LiNO3 + AgCl
nAgCl = nLiCl = 2nH2 = 0,2 mol => mAgCl = 143,5.0,2 = 28,7 g
Câu 3. Dãy nào sau đây chỉ gồm các kim loại tác dụng với dung dịch HCl:
A. Cu; Na, Ag B. Na, Li, Fe C. Cu, K, Na D. Na, Li, Ca
Lời giải:
Đáp án: B
Phương trình phản ứng: 2Na + 2HCl → 2NaCl + H2
2Li + 2HCl → 2LiCl + H2;
Fe + 2HCl → FeCl2 + H2
Xem thêm các phương trình phản ứng hóa học khác:
Li + H2SO4 → Li2SO4 + H2
Li + H3PO4 → Li3PO4 + H2
Li + H3PO4 → Li2HPO4 + H2
Li + H3PO4 → LiH2PO4 + H2
Li + C2H5OH → C2H5OLi + H2
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




