Phản ứng: Mg + HNO3 đặc → Mg(NO3)2 + NO2 + H2O
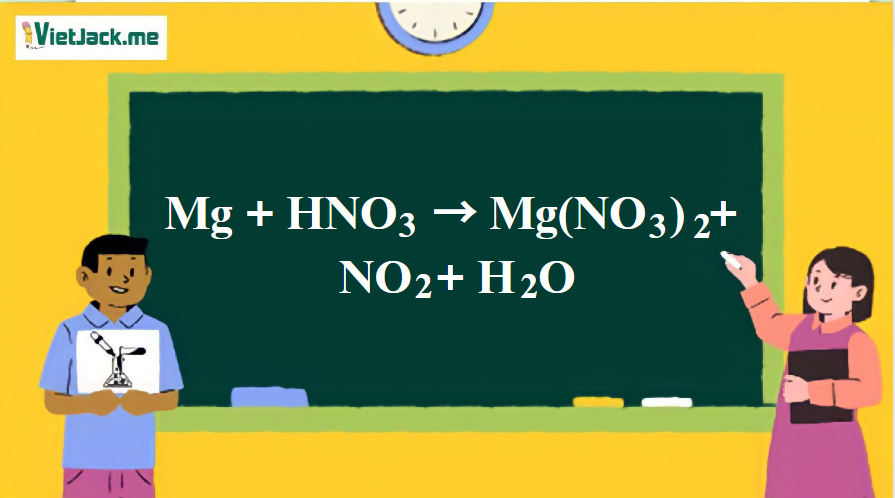
1. Phương trình hóa học của phản ứng Mg tác dụng với HNO3 đặc
Mg + 4HNO3 đặc → Mg(NO3)2 + 2NO2 + 2H2O
2. Điều kiện để Mg tác dụng với HNO3 đặc
Phản ứng giữa magie (Mg) và HNO3 đặc diễn ra ở nhiệt độ thường; phản ứng diễn ra nhanh hơn khi đun nóng.
3. Cách tiến hành thí nghiệm
Lấy vào ống nghiệm 1 – 2 ml dung dịch HNO3 đặc, rồi cho một mảnh nhỏ Mg kim loại vào ống nghiệm đó.
4. Hiện tượng phản ứng
Mg tan dần trong dung dịch, sinh ra khí màu nâu đỏ là nitơ đioxit (NO2).
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của Mg
Trong phản ứng trên, Mg là chất khử
5.2 Bản chất của HNO3
Trong phản ứng này, HNO3 hoạt động như một chất oxi hóa mạnh
6. Mở rộng kiến thức về HNO3
6.1. HNO3 có tính axit
HNO3 là một trong các axit mạnh nhất, trong dung dịch loãng phân li hoàn toàn thành ion H+ và NO3–.
HNO3 mang đầy đủ các tính chất của 1 axit như: làm quỳ tím hóa đỏ, tác dụng bazơ, oxit bazơ và muối của axit yếu hơn tạo thành muối nitrat. Ví dụ:
MgO + 2HNO3 → Mg(NO3)2 + H2O
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
BaCO3 + 2HNO3 → Ba(NO3)2 + CO2 + H2O
6.2. HNO3có tính oxi hóa mạnh:
Axit nitric là một trong những axit có tính oxi hóa mạnh. Tùy thuộc vào nồng độ của axit và độ mạnh yếu của chất khử, mà HNO3 có thể bị khử đến các sản phẩm khác nhau của nitơ.
a. Tác dụng với kim loại:
+ HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat, H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3).
+ Thông thường: HNO3 loãng → NO, HNO3 đặc → NO2 .
+ Với các kim loại có tính khử mạnh: Mg, Al, Zn,… HNO3 loãng có thể bị khử đến N2O, N2, NH4NO3.
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
4Zn + 10HNO3 loãng → 4Zn(NO3)2 + NH4NO3 + 3H2O
* Chú ý: Fe, Al, Cr bị thụ động trong dd HNO3 đặc, nguội do tạo màng oxit bền, bảo vệ kim loại khỏi tác dụng của axit, do đó có thể dùng bình Al hoặc Fe để đựng HNO3 đặc, nguội.
b. Tác dụng với phi kim:
HNO3 có thể oxi hoá được nhiều phi kim, như:
S + 6HNO3 →t0H2SO4 + 6NO2 + 2H2O
C + 4HNO3 →t0CO2 + 4NO2 + 2H2O
5HNO3 + P →t0H3PO4 + 5NO2 + H2O
c. Tác dụng với hợp chất:
HNO3 đặc còn oxi hóa được hợp chất vô cơ và hữu cơ. Vải, giấy, mùn cưa, dầu thông,… bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
4HNO3 + FeO → Fe(NO3)3 + NO2 + 2H2O
4HNO3 + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O
7. Tính chất hóa học của Mg
– Magie là chất khử mạnh:
Mg → Mg2+ + 2e
7.1 Tác dụng với phi kim
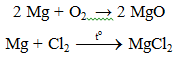
Lưu ý:
– Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
7.2 Tác dụng với axit
– Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
– Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
7.3 Tác dụng với nước
– Ở nhiệt độ thường, Mg hầu như không tác dụng với nước. Mg phản ứng chậm với nước nóng (do tạo thành hidroxit khó tan).
Mg + 2H2O → Mg(OH)2 + H2
8. Tính chất vật lí của Mg
Magie là kim loại tương đối cứng, có màu trắng bạc, chất này rất nhẹ chỉ nặng khoảng 2/3 nhôm nếu cùng thể tích. Magnesium bị bao phủ lớp màng oxit khi để ngoài không khí. Mg có khối lượng riêng là 1,737 (g/cm3) có nhiệt độ nóng chảy là 648 độ C và sôi ở 1095 độ C.
9. Bài tập vận dụng liên quan đến Mg và HNO3
Câu 1: Khi làm thí nghiệm với dung dịch HNO3 đặc thường sinh ra khí nitơ đioxit gây ô nhiễm không khí. Công thức của nitơ đioxit là
A. NH3.
B. NO.
C. NO2.
D. N2O.
Hướng dẫn giải:
Đáp án C
Công thức của nitơ đioxit là NO2.
Câu 2: Hòa tan hết 23,18 gam hỗn hợp X gồm Fe, Mg và Fe(NO3)3 vào dung dịch chứa 0,46 mol H2SO4 loãng và 0,01 mol NaNO3, thu được dung dịch Y (chứa 58,45 gam chất tan gồm hỗn hợp muối trung hòa) và 2,92 gam hỗn hợp khí Z. Cho Y phản ứng vừa đủ với dung dịch chứa 0,91 mol NaOH, thu được 29,18 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Fe(NO3)3 trong X là
A. 46,98%.
B. 41,76%.
C. 52,20%.
D. 38,83%.
Hướng dẫn giải:
Đáp án C
– Y+ NaOH thu được dung dịch chứa Na+ (0,91 + 0,01 = 0,92 mol), SO42−(0,46 mol).
Bảo toàn điện tích vừa đủ ⇒ Y không còn NO3−.
– Đặt u là tổng khối lượng của Fe2+, Fe3+, Mg2+. Đặt nNH4+ = v mol
mmuối = u + 18v + 0,01.23 + 0,46.96 = 58,45 gam (1)
nOH− trong kết tủa = (0,91 − v) mol
→ m↓ = u + 17.(0,91 − v) = 29,18 gam (2)
Từ (1), (2) → u = 13,88 gam và v = 0,01 mol
nNO3−(X)=mX−u62 = 0,15 mol → nFe(NO3)3=0,05mol
→ % Fe(NO3)3 = 0,05.24223,18.100 = 52,20%
Câu 3: Cho hỗn hợp X gồm a mol Fe và 0,21 mol Mg vào dung dịch Y chứa Cu(NO3)2 và AgNO3 (tỉ lệ mol tương ứng 3:2). Sau khi các phản ứng kết thúc, thu được dung dịch Z và 27,84 gam chất rắn T gồm ba kim loại. Hòa tan toàn bộ T trong lượng dư dung dịch H2SO4 đặc nóng, thu được 0,33 mol SO2 (sản phẩm khử duy nhất của H2SO4). Giá trị của a là
A. 0,09.
B. 0,08
C. 0,12.
D. 0,06.
Hướng dẫn giải:
Đáp án A
27,84 gam chất rắn T gồm Fe (x mol), Cu (3y mol) và Ag (2y mol)
Bảo toàn khối lượng:
56x + 64.3y + 108.2y = 27,84 (1)
Bảo toàn electron:
3x + 2.3y + 1.2y = 0,33.2 (2)
Từ (1) và (2) → x = y = 0,06 mol
Bảo toàn electron khi X tác dụng với Y:
(a−x).2+0,21.2=2.3y+1.2y→a=0,09mol
Câu 4: Dãy gồm các chất không bị hòa tan trong dung dịch HNO3 đặc nguội là
A. Al, Zn, Cu
B. Al, Cr, Fe
C. Zn, Cu, Fe
D. Al, Fe, Mg
Hướng dẫn giải
Đáp án B
Các kim loại Al, Cr, Fe bị thụ động hóa trong H2SO4 và HNO3 đặc, nguội do tạo trên bề mặt kim loại một lớp màng oxit đặc biệt, bền với axit và ngăn cản hoặc ngừng hẳn sự tiếp diễn của phản ứng.
Câu 5: Trước khi thi đấu các môn thể thao, các vận động viên thường xoa một ít chất X dưới dạng bột mịn màu trắng làm tăng ma sát và hút ẩm. X là
A. MgCO3. B. CaOCl2. C. CaO. D. Tinh bột.
Hướng dẫn giải
Đáp án A
Chất X là MgCO3có tên gọi là magie cacbonat.
MgCO3là chất bột rắn, màu trắng, mịn, nhẹ có tác dụng hút ẩm rất tốt. Khi thi đấu, bàn tay của các vận động viên thường có nhiều mồ hôi, sẽ làm giảm độ ma sát khiến các vận động viên không thể nắm chắc các dụng cụ thi đấu. Điều này không chỉ ảnh hưởng xấu đến thành tích mà còn gây nguy hểm. MgCO3có tác dụng thấm hút mồ hôi, đồng thời tăng cường độ ma sát giữa bàn tay các các dụng cụ thi đấu. Giúp các vận động viên thi đấu tốt hơn.
Câu 6: Cho 2,4 gam Mg vào dung dịch HCl dư đến khi các phản ứng xảy ra hoàn toàn, thu được V lít H2 (ở đktc). Giá trị của V là
A. 2,24 lít. B. 6,72 lít. C. 3,36 lít. D. 4,48 lít.
Hướng dẫn giải
Đáp án A
Bảo toàn electron:
2nH2 = 2nMg
→ nH2 = nMg = 0,1 mol
V = 2,24 lít
Câu 7: Nung nóng một hỗn hợp gồm CaCO3 và MgO tới khối lượng không đổi , thì số gam chất rắn còn lại chỉ bằng 2/3 số gam hỗn hợp trước khi nung. Vậy trong hỗn hợp ban đầu thì CaCO3 chiếm phần trăm theo khối lượng là :
A. 75,76% B. 24,24% C. 66,67% D. 33,33%
Hướng dẫn giải
Đáp án A
CaCO3 → CaO + CO2↑
Giả sử số mol CaCO3 trong hỗn hợp đầu là 1 mol
→nCO2= nCaCO3= 1 mol
→ mtrước – msau = mCO2 = mtrước – 2/3mtrước
→ mtrước = 3.mCO2 = 3.1.44 = 132g
→ %mCaCO3 = 1.100132.100 = 75,76%
Câu 8: Trong công nghiệp, Mg được điều chế bằng cách nào dưới đây?
A. Điện phân nóng chảy MgCl2.
B. Điện phân dung dịch MgSO4.
C. Cho kim loại K vào dung dịch Mg(NO3)2.
D. Cho kim loại Fe vào dung dịch MgCl2.
Hướng dẫn giải
Đáp án A
Kim loại kiềm thổ chỉ được điều chế bằng phương pháp điện phân nóng chảy muối halogenua
MgCl2 →dpncMg + Cl2
Câu 9: Trong một cốc có a mol Ca2+, b mol Mg2+, c mol Cl–, d mol HCO3–. Biểu thức liên hệ giữa a,b,c,d là:
A. a + b = c + d B. 2a + 2b = c + d
C. 3a + 3b = c + d D. 2a+b=c+ d
Hướng dẫn giải
Đáp án B
Áp dụng định luật bảo toàn điện tích
∑ndientich(+)=∑ndientich(−)
→ 2.nCa2++2.nMg2+=1.Cl−+1.nHCO3−
→ 2a + 2b = c + d
Câu 10: Hòa tan hoàn toàn 3,9 gam hỗn hợp Al và Mg trong dung dịch HCl dư, thu được 4,48 lít (ở đktc) khí H2 và dung dịch chứa m gam muối. Giá trị của m là
A. 11,6.
B. 17,7.
C. 18,1.
D. 18,5.
Hướng dẫn giải:
Đáp án C
nH2=0,2mol→nHClpu=0,4mol
→nCl−(muối) = 0,4 mol
→ mmuối = mkim loại + mCl– muối = 18,1 gam
Câu 11: Cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất. Phần trăm khối lượng của Al trong X là:
A. 34,62%.
B. 65,38%.
C. 30,77%.
D. 69,23%.
Hướng dẫn giải:
Đáp án D
Gọi số mol Cl2 và O2 trong hỗn hợp Y lần lượt là x và y mol.
Gọi số mol Mg và Al trong hỗn hợp X lần lượt là a và b mol.
→x+y=5,622,471x+32y=19,7−7,8→x=0,1y=0,15(mol)
→BTKL:24a+27b=7,8BTelectron:2a+3b=0,1.2+0,15.4→a=0,1b=0,2(mol)
%mAl=0,2.277,8=69,23%
Câu 12: Khi tham gia vào các phản ứng hoá học, nguyên tử kim loại Mg sẽ:
A. nhận proton.
B. cho proton.
C. bị oxi hoá.
D. bị khử.
Hướng dẫn giải:
Đáp án C
Khi tham gia vào các phản ứng hoá học, nguyên tử kim loại Mg sẽ đóng vai trò là chất khử hay chất bị oxi hoá.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




