Phản ứng Mg(OH)2 + HCl → MgCl2 + H2O
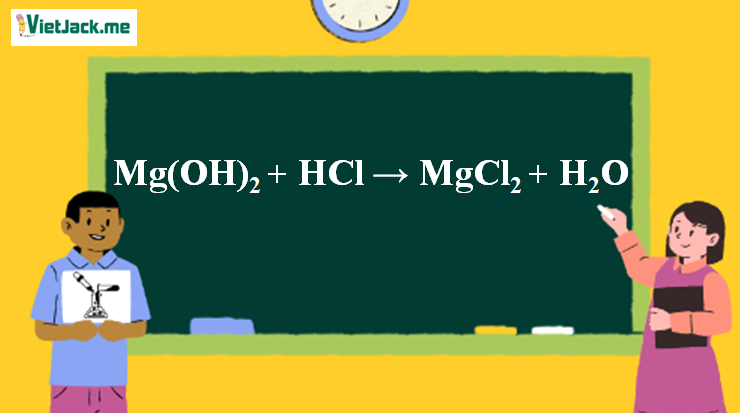
1. Phương trình phản ứng Mg(OH)2 + HCl
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
2. Điều kiện phương trình phản ứng xảy ra
Nhiệt độ thường
3. Hiện tượng phản ứng xảy ra
Khi cho Magie hidroxit tác dụng với dung dịch axit. Chất rắn màu trắng Magie hidroxit (Mg(OH)2) tan dần.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Mg(OH)2 (Magie hidroxit)
Mg(OH)2 mang tính chất hóa học của bazo không tan tác dụng với axit như HCl, HNO3,..
4.2. Bản chất của HCl (Axit clohidric)
HCl tác dụng bazơ tạo thành muối clorua + nước.
5. Mở rộng kiến thức về Mg(OH)2
5.1. Tính chất vật lí
Là chất rắn, có màu trắng, không tan trong nước.
5.2. Tính chất hóa học
Mang tính chất hóa học của bazo không tan
Bị phân hủy bởi nhiệt:
Mg(OH)2 –to→ H2O + MgO
Tác dụng với axit:
2HNO3 + Mg(OH)2 → 2H2O + Mg(NO3)2
2HCl + Mg(OH)2 → 2H2O + MgCl2
5.3. Điều chế
– Cho muối của Magie tác dụng với dung dịch bazơ
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
– Ở quy mô thương mại, Mg(OH)2 được sản xuất bằng cách xử lý nước biển với canxi hydroxit (Ca(OH)2). 600 m3 nước biển sản xuất được khoảng một tấn Mg(OH)2. Ca(OH)2 dễ hòa tan hơn so với Mg(OH)2, nên magiê hydroxit kết tủa thành chất rắn:
Mg2+ + Ca(OH)2 → Mg(OH)2 + Ca2+
5.4. Ứng dụng
– Mg(OH)2 được sử dụng rộng rãi trong ngành sản xuất dược phẩm. Bởi vì đây là nguyên liệu chính để bào chế ra các thuốc kháng axit, giúp trung hòa axit trong dạ dày, giảm triệu chứng khó tiêu, ợ chua, viêm loét.
– Bên cạnh đó, Mg(OH)2 còn được sử dụng để làm chất nhuận tràng, giảm nguy cơ táo bón.
– Nó còn có công dụng chống mồ hôi, khử mùi dưới cánh tay, chữa trị vết loét.
– Xử lý nước thải công nghiệp: Giúp trung hòa nước thải có tính axit.
– Được sử dụng làm các vật liệu chống cháy như nhựa, tấm lợp, lớp phủ bởi nó có đặc tính khử khói và chống cháy. Nó sở hữu đặc tính là là do ở nhiệt độ cao nó sẽ tạo ra MgO, giúp hấp thụ nhiệt trì hoãn sự đánh lửa của chất trong đám cháy và nước thoát ra ngoài làm loãng khí dễ cháy.
Mg(OH) 2 → MgO + H 2 O
– Điều chế MgO là một chất dẫn điện kém nhưng dẫn nhiệt tốt.
– Magiê hydroxide được sử dụng là chất phụ gia với số E là E528, giúp điều chỉnh độ axit trong thực phẩm.
6. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
6.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl–
6.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl  FeCl2 + H2
FeCl2 + H2
2Al + 6HCl  2AlCl3 + 3H2
2AlCl3 + 3H2
Cu + HCl → không có phản ứng
6.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl  CuCl2 + H2 O
CuCl2 + H2 O
Fe2 O3 + 6HCl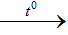 2FeCl3 + 3H2 O
2FeCl3 + 3H2 O
6.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 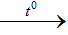 MnCl2 + Cl + 2H2 O
MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
7. Câu hỏi vận dụng liên quan
Câu 1. Dãy chất nào sau đây phản ứng được với dung dịch HCl
A. Mg(OH)2, Fe, CaO
B. Cu(OH)2, Cu, ZnO
C. NaOH, Al, ZnO
D. KOH, Fe, CO2
Lời giải:
Câu 2. Kim loại nào sau đây phản ứng được cả với dung dịch HCl loãng và NaOH
A. Cr
B. Cu
C. Zn
D. Ag
Lời giải:
Câu 3. Cho dãy các bazơ sau: NaOH, Mg(OH)2, Ca(OH)2, Cu(OH)2, Fe(OH)2. Số bazo không tan là:
A. 2
B. 3
C. 4
D. 1
Lời giải:
Câu 4. Dãy các bazo bị nhiệt phân hủy tạo thành oxit bazo
A. Cu(OH)2; Zn(OH)2; Al(OH)3; Fe(OH)2
B. Cu(OH)2; Zn(OH)2; Al(OH)3; NaOH
C. Fe(OH)3; Cu(OH)2; KOH; Fe(OH)2
D. Fe(OH)3; Cu(OH)2; Ca(OH)2; Fe(OH)2
Lời giải:
Câu 5. Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2, Mg(OH)2, Fe(OH)3, LiOH, KOH. Hãy cho biết số bazo bị nhiệt phân hủy là:
A. 3
B. 4
C. 5
D. 2
Lời giải:
Xem thêm các phương trình hóa học khác:
Zn + H2SO4 → ZnSO4 + H2
Zn + H2SO4 → ZnSO4 + SO2 + H2O
Zn + HNO3 → Zn(NO3)2 + NO2 + H2O
Zn + HNO3 → Zn(NO3)2 + NO + H2O
Zn + HNO3 → Zn(NO3)2 + N2 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




